|
|
|
高考化学试题《盐类水解的原理》在线测试(2017年最新版)(三)
2017-03-05 14:12:58
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 0.1mol/L K2CO3溶液中,由于CO32-的水解,使得c(CO32-)<0.1mol/L。如果要使c(CO32-)更接近于0.1mol/L,可以采取的措施是
A.加入适量KOH
B.加入适量水
C.加入少量盐酸
D.加热
|
2、填空题 (1)①在配制FeCl3溶液时,常在溶液中加入一些_________________以抑制其水解;其水解反应的离子方程式为
②用Al2(SO4)3与NaHCO3溶液混合反应就是泡沫灭火器的工作原理,请写出反应的离子方程式________________________________________________________。
③请按顺序排列出1mol/LNH4Cl溶液中各种离子浓度大小关系_________。请详细解释该溶液呈现酸性、碱性或中性的原因_______________________ 。
(2)25℃时,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得溶液的pH=10。试回答以下问题:
所得溶液中由水电离出的c(H+)________0.1mol/LNaOH溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
(3)将相同温度下相同浓度的下列溶液:
A.HCl
B.CH3COOH
C.NH4Cl
D.CH3COONa E.NaOH F.NaCl
|
按pH由大到小的顺序排列
(填序号)
(4)加热蒸干AlCl3溶液得到
;接下来灼烧得
;(填化学式)
用离子方程式及简短的文字说明原因
3、选择题 常温下,0.1 mol/L氨水溶液中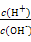 =1×10-8,下列叙述不正确的是( )
=1×10-8,下列叙述不正确的是( )
A.该溶液中氢离子的浓度:c(H+)=1×10-11 mol/L
B.0.1 mol/L氨水溶液与0.1 mol/L HCl溶液等体积混合后所得溶液中:c(N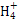 )+c(H+)=c(Cl-)+c(OH-)
)+c(H+)=c(Cl-)+c(OH-)
C.0.1 mol/L的氨水溶液与0.05 mol/L H2SO4溶液等体积混合后所得溶液中:c(N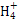 )+c(NH3)+c(NH3·H2O)=2c(S
)+c(NH3)+c(NH3·H2O)=2c(S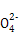 )
)
D.浓度均为0.1 mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则c(N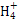 )>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+)
)>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+)
4、选择题 下列叙述不正确的是
A.在0.1 mol/LCH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
B.在0.1 mol/L某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.CH3COOH和CH3COONa的混合溶液中,若c(CH3COO-)大于c(Na+),则溶液显酸性
D.10 mL0.02 mol/LHCl溶液与10 mL0.02 mol/LBa(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
5、选择题 Na2CO3水溶液中存在CO32-+H2O?HCO3-+OH-平衡。下列说法不正确的是( ? )
A.稀释溶液,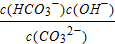 增大
增大
B.通入CO2,溶液pH减小
C.升高温度,此平衡常数增大
D.加入NaOH固体, 减小
减小
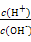 =1×10-8,下列叙述不正确的是( )
=1×10-8,下列叙述不正确的是( )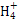 )+c(H+)=c(Cl-)+c(OH-)
)+c(H+)=c(Cl-)+c(OH-)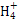 )+c(NH3)+c(NH3·H2O)=2c(S
)+c(NH3)+c(NH3·H2O)=2c(S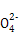 )
)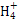 )>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+)
)>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+)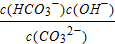 增大
增大 减小
减小