微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 可以用离子方程式H++OH-=H2O来表示的化学反应是( )
A.硝酸和Ba(OH)2溶液的反应
B.盐酸和Cu(OH)2的反应
C.醋酸和NaOH溶液的反应
D.稀硫酸和Ba(OH)2溶液的反应
参考答案:A、硝酸是强酸,Ba(OH)2溶液是强碱,二者反应生成的硝酸钡是可溶性的盐,故A正确;
B、氢氧化铜是弱碱,在离子方程式中不能拆成离子的形式,故B错误;
C、醋酸是弱酸,在离子方程式中不能拆成离子的形式,故C错误;
D、稀硫酸和Ba(OH)2溶液生成的硫酸钡是沉淀,不能拆成离子的形式,故D错误.
故选A.
本题解析:
本题难度:一般
2、选择题 某粗盐中含有Ca2+、Mg2+、SO42-等杂质,现测定氯化钠含量.取120g粗盐溶于水过滤除去6g不溶物,向滤液中依次加入过量的下列试剂:1mol/L的氢氧化钠溶液200mL、4.56g固体氯化钡、31.8%的碳酸钠溶液10g,发现白色沉淀逐渐增多,过滤除去沉淀物,再往滤液中加入过量的盐酸,使溶液呈酸性,加热蒸发得氯化钠晶体126.65g,则粗盐中含氯化钠的质量分数为( )
A.94.1%
B.92.9%
C.86.3%
D.83.2%
参考答案:200mL1mol/L的氢氧化钠溶液中n(NaOH)=0.2L×1mol/L=0.2mol,
10g31.8%的碳酸钠溶液中m(Na2CO3)=10g×31.8%=3.18g,故n(Na2CO3)=3.18g106g/mol=0.03mol,
由钠离子守恒,加入氢氧化钠、碳酸钠引入的氯化钠为(0.2mol+0.03mol×2)×58.5g/mol=15.21g,
故粗盐中氯化钠的质量为126.65g-15.21g=111.44g,粗盐中氯化钠的质量分数为111.44g120g×100%=92.9%,
故选B.
本题解析:
本题难度:简单
3、填空题 将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-按可能大量共存于同一溶液的情况,把他们分成A、B两组,而且每组中均含两种阳离子和两种阴离子.
(1)A组:______;B组:______.
(2)按要求写出A组与B组中离子相互反应的离子方程式
生成无色气体______,没有明显现象______.
参考答案:(1)Cu2+与CO32-、OH-反应生成沉淀而不能大量共存,假设A组中含有Cu2+离子,则B组中含有CO32-、OH-离子,
H+与CO32-、OH-反应而不能大量共存,则H+存在于A组,
根据溶液呈电中性原则,则A组还应有NO3-、Cl-,B组还应有Na+、K+,
所以A组含有的离子有:Cu2+、H+、NO3-、Cl-,B组含有的离子有:Na+、K+、CO32-、OH-(或相反),
故答案为:Cu2+、H+、NO3-、Cl-;Na+、K+、CO32-、OH-;
(2)A组与B组中离子相互反应生成无色气体的反应为:2H++CO32-=CO2↑+H2O,
没有明显现象的反应为:OH-+H+=H2O,
故答案为:2H++CO32-=CO2↑+H2O;OH-+H+=H2O.
本题解析:
本题难度:一般
4、简答题 (1)若向NaHSO4溶液中逐滴加入Ba(OH)2溶液,使原溶液中的SO42-恰好完全沉淀,试写出该反应的离子方程式______
(2)明矾是一种无色晶体,可溶于水并形成Al(OH)3胶体来净水.已知明矾水溶液的主要成分是KAl(SO4)2,现向明矾溶液中逐滴加入Ba(OH)2溶液,当Al3+恰好全部沉淀时,试写出该反应的离子方程式______.
参考答案:(1)假设NaHSO4为1mol,使原溶液中的SO42-恰好完全沉淀,需要Ba(OH)21mol,则发生反应的离子的物质的量分别为1mol,离子方程式为H++SO42-+Ba2++OH-=BaSO4↓+H2O,故答案为:H++SO42-+Ba2++OH-=BaSO4↓+H2O;
(2)假设KAl(SO4)2为2mol,溶液中含有2molAl3+,4molSO42-,当Al3+恰好全部沉淀时,需要3molBa(OH)2,即加入3molBa2+,6molOH-,反应的离子方程式为2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓,
故答案为:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓.
本题解析:
本题难度:一般
5、选择题 下列离子方程式表达不正确的是
A.在硫酸亚铁溶液中通入氧气:4Fe2++O2+4H+=4Fe3++2H2O
B.用0.3mol/L的氯化铵溶液除去氢氧化铝中少量的氢氧化镁:
Mg(OH)2 +2NH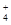 =Mg2++2NH3·H2O
=Mg2++2NH3·H2O
C.用惰性电极电解硫酸铜溶液:2Cu2++ 2H2O 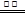 2Cu↓ +O2↑ +4H+
2Cu↓ +O2↑ +4H+
D.酸性高锰酸钾和过氧化氢制取少量氧气:4MnO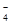 +4H2O2+12H+=4Mn2++7O2↑+10H2O
+4H2O2+12H+=4Mn2++7O2↑+10H2O
参考答案:D
本题解析:ABC均正确
D:电子得失不守恒:2MnO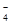 +5H2O2+6H+=2Mn2++5O2↑+8H2O
+5H2O2+6H+=2Mn2++5O2↑+8H2O
答案为D
本题难度:一般