| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《与量有关的离子方程式的书写》高频试题强化练习(2017年最新版)(六)
(2)目前已开发出用电解法制取ClO2的新工艺。 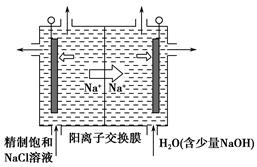 ①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图。则阳极产生ClO2的电极反应式为_____________________________________。 ②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol,用平衡移动原理解释阴极区pH增大的原因:______________________________________。 (3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN-a mg/L,现用ClO2将CN-氧化,产物中有两种气体生成,其离子反应方程式为________________;处理100 m3这种污水,至少需要ClO2________mol。 参考答案:(1)①B ②0.1? (2)①Cl--5e-+2H2O=ClO2↑+4H+ 本题解析:①电解饱和食盐水制取ClO2,ClO2为氧化产物,故应在阳极产生,Cl-失去5个电子生成ClO2,而ClO2中含有氧元素,故还有H2O参加反应,再根据质量守恒配平电极反应式即可。②阴极产生标准状况下112 mL H2,转移电子0.01 mol,消耗的n(H+)=0.01 mol,为保持溶液呈电中性,故有相同物质的量的Na+通过阳离子交换膜移向阴极。阴极上H2O电离出的H+放电,导致H2O的电离平衡向右移动,OH-浓度增大,溶液pH增大。(3)处理污水时生成的两种气体不能具有污染性,应为CO2和N2,再根据得失电子守恒和原子守恒配平即可。由离子反应方程式可知消耗的ClO2的物质的量等于污水中CN-的物质的量,即n(ClO2)=n(CN-)= 本题难度:一般 |
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学知识点归纳《弱电解质电.. | ||