微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 按要求作答:
(1)FeCl3水溶液呈酸性,原因是(用离子方程式表示):______,实验室配制FeCl3溶液的方法是______.
(2)泡沫灭火剂中装有Al2(SO4)3溶液、NaHCO3溶液及起泡剂.写出使用时发生反应的离子方程式:______.
(3)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气.已知:N2(g)+2O2(g)═2NO2(g),△H=+67.7KJ?mol-1;N2H4(g)+O2(g)═N2(g)+2H2O?(g),△H=-534KJ?mol-1
则N2H4和NO2反应的热化学方程式为______.
(4)常温下,设pH?均为6的H2SO4和A12(SO4)3溶液中由水电离出的c(H+)分别为c1、c2,则
=______.
(5)常温下,pH=13的Ba(OH)2溶液aL与PH=1的H2SO4溶液bL混合(混合后溶液体积变化忽略不计).若所得混合溶液PH=12,则a:b=______.
参考答案:(1)Fe3+易水解,水解生成H+,水解的离子方程式为Fe3++3H2O?Fe(OH)3+3H+,配制溶液时,可加入盐酸抑制FeCl3水解,防止生成沉淀而导致溶液变浑浊;
故答案为:Fe3++3H2O?Fe(OH)3+3H+;配制溶液时,可加入盐酸抑制FeCl3水解,防止生成沉淀而导致溶液变浑浊;
(1)Al2(SO4)3溶液水解成酸性,NaHCO3溶液水解成碱性,二者发生互促水解生成Al(OH)3和CO2,反应的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)①N2(g)+2O2(g)═2NO2(g),△H=+67.7KJ?mol-1;②N2H4(g)+O2(g)═N2(g)+2H2O (g),△H=-534KJ?mol-1
依据盖斯定律,②×2-①得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135,7KJ/mol;
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135,7KJ/mol;
(4)常温下,水溶液中存在离子积常数,[H+]?[OH-]=10-14;pH 均为6的H2SO4和溶液中由水电离出的氢离子浓度C1=10-8mol/L;A12(SO4)3溶液中,铝离子水解生成氢氧化铝和盐酸,由水电离出的C2=10-6mol/L;则C1C2=10-810-6=1100;
故答案为:1:100;
(5)常温下,pH=13的Ba(OH)2溶液aL,溶液中氢氧根离子物质的量=10-1mol/L×aL=0.1amol;PH=1的H2SO4溶液bL中含氢离子物质的量=0.1mol/L×bL=0.1bmol;混合后溶液体积变化忽略不计,溶液体积为(a+b)L;混合溶液中氢氧根离子浓度=10-2mol/L;所以得到0.1a-0.1ba+bmol/L=10-2mol/L;计算得到a:b=11:9,
故答案为:11:9.
本题解析:
本题难度:一般
2、填空题 甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备。甲醛与气态甲醇转化的能量关系如图所示。
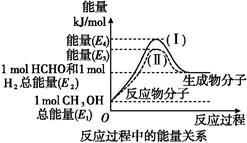
(1)甲醇催化脱氢转化为甲醛的反应是 (填“吸热”或“放热”)反应。
(2)过程Ⅰ与过程Ⅱ的反应热是否相同? ,原因是
(3)写出甲醇催化脱氢转化为甲醛的热化学反应方程式: 。
参考答案:(1)吸热 91exam.org
(2)相同 一个化学反应的反应热仅与反应始态和终态有关,而与反应的途径无关
(3)CH3OH(g)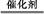 HCHO(g)+H2(g) ΔH=+(E2-E1)kJ·mol-1
HCHO(g)+H2(g) ΔH=+(E2-E1)kJ·mol-1
本题解析:(1)E1<E2,甲醇催化脱氢转化为甲醛的反应是吸热反应。
(2)反应热与反应的始态和终态有关,与反应的途径无关,故反应热相同。
本题难度:一般
3、填空题 (14分)丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知: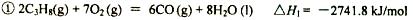
(1)反应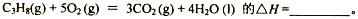
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
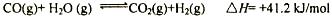
①下列事实能说明该反应达到平衡的是
a.体系中的压强不发生变化
b.
c.混合气体的平均相对分子质.量不发生变化
d.CO2的浓度不再反生变化
②5min后体系达到平衡,经测定,H2为0.8mol,则v(H2)= 。
③向平衡体系中充入少量CO则平衡常数___ _(填“增大”、“减小”或“不变”)。
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2—。在电池内部O2—由__ __极移向___ _极(填“正”或“负”);电池的正极电极反应式为 。
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____ 。
参考答案:(1) -2219.9kJ/mol(2分)
(2)①bd(2分) ②0.16 mol/(L·min) (2分) ③不变(2分)
(3)正、负(2分) O2+ 4e- ="2" O2- (2分)
(4)有大量无色气泡(或气体)产生,并且有白色沉淀产生 (2分)
本题解析:(1)根据盖斯定律,此反应的反应热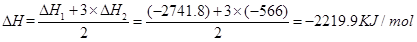 。
。
(2)①判断反应是否达到平衡状态,主要看正逆反应速率是否相等。因此答案为bd。
②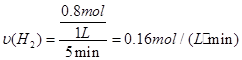
③平衡常数只受温度的影响,加入CO,会影响平衡的移动,但不改变平衡常数,故平衡常数不变。
(3)电池的正极反应式为O2+4e- =2O2-,故在电池内部O2—由正极移向负极。
(4)用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液时,阴极上放电的离子为氯离子,因此可观察到的现象为产生气泡,并有白色沉淀生成。
考点:电化学基础;热化学方程式
点评:本题是对电化学及热化学的综合考查,属于能力提升题。也是高考中常考的综合题。复习备考过程中,学生应特别注意加强对这类题型的训练。解题的关键在于知识的综合应用。
本题难度:困难
4、选择题 下列对H2(g)+ Cl2( g)=2HCl(g) △H(298K)=-184.6 kJ·mol-1的叙述正确的是?
[? ]
A.1分子H2和Cl2反应,放出热量184. 6kJ
B.1mol H2(g)完全反应生成2mol HCl(g),放出的热量为184. 6kJ
C.在101kPa、25℃的条件下,1mol H2(g)和1mol Cl2(g)完全反应生成2mol HCl(g),放出的热量为184. 6kJ
D.在101kPa、25℃的条件下,1mol H2(g)和1mol Cl2(g)完全反应生成2mol HCl(g),吸收的热量为184. 6kJ
参考答案:C
本题解析:
本题难度:简单
5、选择题 已知:
(1)H2(g)+1/2O2(g)===H2O(g); △H1=a kJ·mol-1
(2)2H2(g)+O2(g)===2H2O(g); △H2=b kJ·mol-1
(3)H2(g)+1/2O2(g)===H2O(l); △H3=c kJ·mol-1
(4)2H2(g)+O2(g)===2H2O(l); △H4=d kJ·mol-1
下列关系式中正确的是
[? ]
A.a<c<0
B.b>d>0
C.2a=b<0
D.2c=d>0
参考答案:C
本题解析:
本题难度:一般