微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列变化中,不需要破坏化学键的是( )
A.氯化氢溶于水
B.加热氯酸钾使其分解
C.碘升华
D.氯化钠熔化
参考答案:A、氯化氢是共价化合物溶于水电离成氯离子和氢离子,破坏了共价键,故A不符合;
B、氯酸钾分解生成了氧气和氯化钾,旧化学键断裂,新化学键形成,故B不符合;
C、碘升华是碘分子间的距离增大直接变成气体的过程,是物理过程,不需破坏化学键,故C符合;
D、氯化钠熔化破坏了离子键,故D不符合;
故选C.
本题解析:
本题难度:一般
2、填空题 Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
 (1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
(1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
 (2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
 a.NaOH? b.Zn c.Fe? d.NH3·H2O
a.NaOH? b.Zn c.Fe? d.NH3·H2O
 (3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是
 。若电解电路中通过2mol电子,MnO2的理论产量为 。
。若电解电路中通过2mol电子,MnO2的理论产量为 。
参考答案:(1)Zn(或锌) 正极 (2)锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀
 b?(3)2H++2e-→H2 ,87g
b?(3)2H++2e-→H2 ,87g
本题解析:(1) 负极上是失电子的一极 Zn失电子有负极经外电路流向正极。(2)锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀。除杂的基本要求是不能引入新杂质,所以应选Zn将Cu2+ 置换为单质而除去。(3)阴极上得电子,发生还原反应, H+得电子生成氢气。因为MnSO4~MnO2~2 e-,通过2mol电子产生1molMnO2,质量为87g。
本题难度:一般
3、填空题 (12分)氯化铍是用于制有机铍化合物和金属铍的重要原料。
(1)BeCl2分子中组成元素Be的基态原子的价电子排布式为?,其元素的第一电离能?B元素(填“>”或“<” 或“=”),原因是?。
(2)已知BeCl2加热易升华,液态BeCl2不导电,BeCl2晶体类型为?; BeCl2中Be原子的杂化轨道类型是?。
(3)用阴离子树脂交换法提取一种组成元素为氯和铍的阴离子,该阴离子内铍原子达到8电子稳定结构,则该离子内存在的微粒间的作用力是?,阴离子的结构式为?。
参考答案:(1)2s2 (2分);?>?(1分);? Be的2s轨道全充满,体系能量低(2分)。?
(2)分子晶体(1分);? sp (2分)
(3)共价键和配位键?(2分) ; 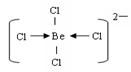 (2分)
(2分)
本题解析:(1)Be是第ⅡA元素,所以根据构造原理可知,Be原子的基态价电子排布式为2s2。非金属性越强,第一电离能越大,但由于Be的2s轨道全充满,稳定性强,体系能量低,所以第一电离能大于B的。
(2)根据BeCl2的物理性质可判断,形成的晶体应是分子晶体、BeCl2分子中心原子没有孤对电子,所以是直线型结构,采用sp杂化。
(3)阴离子内铍原子达到8电子稳定结构,说明分子内除了含有共价键以外,还一定存在配位键,即氯原子提供电子对,Be原子提供空轨道,结构式为 。
。
本题难度:一般
4、实验题 (15分)I.(9分)某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。
实验方案
| 实验现象
|
①用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞
| (A)浮于水面,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色
|
②向新制的H2S饱和溶液中滴加新制的氯水
| (B)产生气体,可在空气中燃烧,溶液变成浅红色
|
③钠与滴有酚酞试液的冷水反应
| (C)反应不十分强烈,产生的气体可以在空气中燃烧
|
④镁带与2 mol·L-1的盐酸反应
| (D)剧烈反应,产生可燃性气体
|
⑤铝条与2 mol·L-1的盐酸反应
| (E) 生成淡黄色沉淀
|
请你帮助该同学整理并完成实验报告:
(1)实验目的:探究同周期元素的金属性和非金属性的递变规律。
(2)实验用品:
仪器:①试管 ②酒精灯 ③胶头滴管 ④试管夹⑤镊子⑥小刀⑦玻璃片⑧砂纸 ⑨烧杯等。
药品:钠、镁带、铝条、2 mol·L-1的盐酸、新制的氯水、饱和的H2S溶液等。
(3)实验内容:(填写与实验方案相对应的实验现象)
① ② ③ ④ ⑤ (用A-E表示)
写出③的离子方程式 。
(4)实验结论: 。
II. (6分)实验室利用如图装置进行中和热的测定,请回答下列问题:
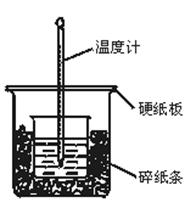
(1)从实验装置上看,图中尚缺少一种玻璃仪器是 。
(2)做1次完整的中和热测定实验,温度计需使用 次。
(3)某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?
参考答案:I.(9分)
(3)① B ②E ③ A ④ D ⑤ C (共3分,错1个扣1分,错3个以上不得分
2Na+2H2O=2Na++2OH-+H2↑ (2分)
(4)金属性:Na > Mg > Al 非金属性:Cl > S (4分)
II. (6分)(1)环形玻璃搅拌棒(2分)
(2)3次(2分) (3)不同意,因为不同的温度计误差不同。(2分)
本题解析:I中通过实验考查了元素周期律相关知识,主要是第三周期元素单质的金属性及非金属的强弱比较。II是关于中和热实验的测定,实验的关键是减小热量损失,减少实验误差。
本题难度:困难
5、选择题 下列离子方程式书写正确的是
A.将过量的NaOH溶液滴入同浓度的少量Ca(HCO3)2溶液中
B.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全
C.向Ca(ClO)2溶液中通入适量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
D.向FeI2溶液中加入少量氯水:2Fe2++Cl2=2Fe3++2Cl-
参考答案:A
本题解析:分析:A.将过量的NaOH溶液滴入同浓度的少量Ca(HCO3)2溶液,全部生成CO32-,CO32-部分转化为CaCO3沉淀;
B.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全,生成BaSO4、NH3?H2O和H2O;
C.SO2具有还原性,与HClO发生氧化还原反应;
D.I-还原性大于Fe2+.
解答:A.将过量的NaOH溶液滴入同浓度的少量Ca(HCO3)2溶液,反应的离子方程式为Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+
CO32-,故A正确;
B.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全,反应的离子方程式为Ba2++2OH-+H++NH4++SO42-=BaSO4↓+H2O+NH3?H2O,故B错误;
C.SO2具有还原性,与HClO发生氧化还原反应,应生成CaSO4沉淀,故C错误;
D.I-还原性大于Fe2+,向FeI2溶液中加入少量氯水发生:2I-+Cl2=I2+2Cl-,故D错误.
故选A.
点评:本题考查离子方程式的书写,题目难度中等,题中易错点为C和D,注意氧化还原反应问题.
本题难度:简单