微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是

[? ]
甲 乙 丙 丁
A. Cu CuCl2 CuO Cu(NO3)2
B.Na2CO3 NaOH NaHCO3 CO2
C. Fe FeCl3 Fe(OH)3 Fe2O3
D.Al2O3 Al(OH)3 NaAlO2 AlCl3
参考答案:B
本题解析:
本题难度:一般
2、填空题 (共10分)在铝制易拉 罐中收集满CO2,然后倒入10mL浓NaO
罐中收集满CO2,然后倒入10mL浓NaO H溶液,迅速密封易拉罐口,可以观察到易拉罐突然变瘪了,原因是 _____________________,反应的离子方程式为 ___________________。
H溶液,迅速密封易拉罐口,可以观察到易拉罐突然变瘪了,原因是 _____________________,反应的离子方程式为 ___________________。
一段时间后,又可以观察到 ______________________,
原因是 ______________________,反应的化学方程式为
___________________ ___________。
___________。
参考答案:

本题解析:略
本题难度:一般
3、选择题 将a g铝粉加入过量NaOH溶液中充分反应后,铝粉完全溶解,并收集到标准状况下b L氢气,所得溶液中共有c个溶质离子,反应中转移电子d个。则阿伏加德罗常数(NA)可表示为
A.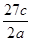
B.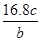
C.
D.
参考答案:C
本题解析:氢气的物质的量是 ,转移电子的物质的量是
,转移电子的物质的量是 ,所以阿伏加德罗常数(NA)可表示为
,所以阿伏加德罗常数(NA)可表示为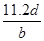 ;铝的物质的量是
;铝的物质的量是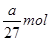 ,转移电子的物质的量是
,转移电子的物质的量是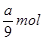 ,所以阿伏加德罗常数(NA)可表示为
,所以阿伏加德罗常数(NA)可表示为 ,C正确;由于溶液中溶质既有氢氧化钠,又有偏铝酸钠,不能用c表示,所以答案选C。
,C正确;由于溶液中溶质既有氢氧化钠,又有偏铝酸钠,不能用c表示,所以答案选C。
点评:该题的关键是明确反应的原理,以及微粒个数与阿伏加德罗常数的关系,如何结合题意灵活运用即可,有利于培养学生的逻辑推理能力和抽象思维能力,提高学生的应试能力。
本题难度:一般
4、填空题 (8分)无铁硫酸铝是制造高档纸张和高级织物的重要原材料,制取无铁硫酸铝的工艺流程如下图所示。铝土矿酸溶后得到含铁(Fe2+和Fe3+)的硫酸铝溶液,再经过后续加工,最终得到成品无铁硫酸铝(溶液中各种金属离子开始沉淀和沉淀完全时的pH见表)。
(1) 试剂X可以用下列试剂中的__________(填编号)
a.铝土矿粉? b.氢氧化钠? c.氧化钙
?
| 开始
| 完全
|
Fe2+
| 7.6
| 9.7
|
Fe3+
| 2.7
| 3.7
|
Al3+
| 3.3
| 5.0
|
Mn2+
| 8.3
| 9.8
|
(2)生产中控制pH为3而不大于3的原因是_________________??;
(3)除铁时,必须先加入高锰酸钾溶液,目的是_____________________;高锰酸钾溶液和硫酸锰溶液反应生成活性二氧化锰,写出反应的化学方程式____________________??;
(4)滤渣的含铁成分是__________;
(5)活性二氧化锰能和Fe(OH)3发生吸附共沉作用,用化学平衡理论解释活性二氧化锰的作用____________?。
参考答案:(1)a?(2分)
(2)pH超过3.3将导致Al3+沉淀,降低成品产量(意思合理即可)(1分)
(3)蒸发、结晶(各1分,共2分)
(4)①把Fe2+转化为Fe3+;(1分)
②2KMnO4 + 3MnSO4 + 2 H2O → 5MnO2↓+ 2H2SO4 + K2SO4(2分)
H2O → 5MnO2↓+ 2H2SO4 + K2SO4(2分)
(5)Fe(OH)3(1分),? Fe3++3H2O Fe(OH)3 + 3H+(2分)
Fe(OH)3 + 3H+(2分)
(6)吸附Fe(OH)3,促使Fe3+水解而充分沉淀(或促使水解平衡正向移动)(1分)
本题解析:略
本题难度:一般
5、选择题 实验室中要使AlCl3溶液中的Al3+离子全部沉淀出来,适宜用的试剂是
A.NaOH溶液
B.Ba(OH)2溶液
C.盐酸
D.氨水
参考答案:D
本题解析:A、B项:都是强碱溶液,碱少量Al3+会剩余一部分留在溶液中,过量Al3+会转化为AlO2-在溶液中,所以在使用的多少的问题上无法确定,故错。C项:盐酸不与Al3+反应,故错。D项:加入氨水使Al3+转化为Al(OH)3沉淀,即使氨水过量沉淀也不溶解,故对。故选D。
点评:本题看的是铝离子(Al3+)与碱溶液的反应,学生要注意的是,在往含有氯离子(Al3+)的溶液中滴加强碱,现象为先有沉淀,后沉淀消失;若滴加弱碱氨水,则生成沉淀但不溶解。
本题难度:一般