微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 利用化学反应可以制备新物质,下列是实验室中常见的药品和装置:
药品:过氧化氢溶液、二氧化锰、浓盐酸、氢氧化钠溶液、浓硫酸、饱和氯化钠溶液、水.
装置:

(1)利用上述药品在实验室中能制备氯气和氧气,二氧化锰的作用分别为______、______.
(2)制取氯气选用的发生装置为______,用装置C除去氯气中混有的HCl气体,C中应盛装的试剂为______,气体从______管进;装置D的作用是______.
(3)实验室制取氧气的反应原理是______.制备并收集一瓶干燥的氧气,装置中导管连接顺序为______→c→d→______→______;其中C中应盛装的试剂为______.
2、填空题 纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤,水洗除去其中的Cl-再烘干、焙烧除去水分得到固体TiO2。用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定
Ti3+至全部生成Ti4+。请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为______________________________。
(2)检验TiO2·xH2O中Cl-是否被除净的方法是______________________________。
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是___________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的________(填字母代号)。
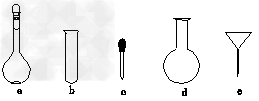
(4)滴定终点的现象是_________________________。
(5)滴定分析时,称取TiO2(摩尔质量为M?g/mol)试样w?g,消耗c?mol/L?NH4Fe(SO4)2标准溶液V?mL,则TiO2质量分数表达式为______________________________________。
(6)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果______。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果________。
3、实验题 蒸馏是实验室制备蒸馏水的常用方法。
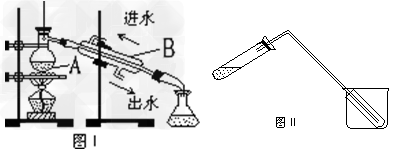
⑴图I是实验室制取蒸馏水的常用装置,图中明显的错误是______________。
⑵仪器A的名称是________,仪器B的名称是_____________。
⑶实验时A中除加入少量自来水外,还需加入少量_________,其作用是____________。图II装置也可用于少量蒸馏水的制取(加热及固定仪器略),其原理与图I完全相同。该装置中使用的玻璃导管较长,其作用是_________;烧杯中还应盛有的物质是___________。
4、选择题 某同学设计如下实验测量mg铜银合金样品中铜的质量分数
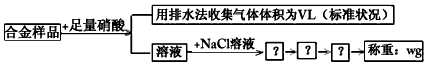
下列说法中不正确的是
[? ]
A.合金的熔点比其成分金属低,通常比成分金属具有更优良的金属特性
B.铜银都能与稀硝酸反应,收集到VL气体不全为NO
C.操作I是过滤,操作Ⅱ是洗涤,操作Ⅲ应足烘干
D.根据反应收集到气体体积可以计算铜和银的质量分数
5、填空题 实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的。
溶解时:____。
过滤时:____ 。
蒸发时:____。