微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有三种溶液分别是①、②、③,在Na2CO3溶液中加入①有白色沉淀产生,继续加入②时白色沉淀全部溶解同时产生气泡,再加入③时又产生白色沉淀.设每次加入反应物都能完全反应,则上述①②③三溶液应是下列的哪一组( )
| ① | ② | ③
(A)
BaCl2
HNO3
Na2SO4
(B)
CaCl2
HNO3
KCl
(C)
KCl
H2SO4
CaCl2
(D)
BaCl2
H2SO4
CaCl2
|
A.A
B.B
C.C
D.D
参考答案:A
本题解析:
本题难度:简单
2、简答题 有一已磨成粉末的混合物试样,是由下列六种物质中的若干种等量组成﹕
(A)NaCl (B)KCl (C)CaCl2 (D)CuSO4(无水) (E)Na2SO4 (F)Na2CO3
为了要确定该粉末试样的成分,某研究性学习小组先查了资料后,研拟了一个检验粉末试样的流程图,并在老师的指导下在化学实验室中进行实验.以下是该小组实验报告的一部份:
实验一:用烧杯取粉末试样约2g,加蒸馏水约100mL,搅拌后形成无色的透明溶液X.
实验二:在溶液X中加了盐酸,观察到在溶液中陆续产生气泡,至溶液不再冒气泡,溶液仍为无色透明(贴上卷标Y).
实验三:在无色透明的溶液Y中,滴加BaCl2溶液,即见白色沉淀.
实验四:继续滴加BaCl2溶液,至白色沉淀不再产生后,过滤分离出白色沉淀,得到透明的无色滤液Z.
实验五:在滤液Z中,滴入AgNO3溶液,则见白色沉淀,加入稀硝酸,沉淀不溶解.
(1)根据上述实验报告,原粉末中一定没有哪两种物质______﹖(从(A)-(F)中选两项,填字母)
(2)原粉末中,一定含有哪两种物质______﹖(从(A)-(F)中选两项)
(3)若只需回答上述(1)(2)的问题,你认为该小组同学不需要做哪两个实
验______
(A)实验一 (B)实验二 (C)实验三 (D)实验四 (E)实验五.
参考答案:由于硫酸铜的溶液呈蓝色,所以取适量固体混合物于烧杯中,加入蒸馏水搅拌,混合物完全溶解,得到无色透明溶液,可以说明固体中无硫酸铜;
无色的透明溶液X加盐酸能够生成气体,所以X中含有碳酸钠,因为CaCl2与Na2CO3会生成沉淀,所以不含有CaCl2;
在无色透明的溶液Y中,滴加BaCl2溶液,即见白色沉淀,说明含有 Na2SO4;
滴入AgNO3溶液,则见白色沉淀,加入稀硝酸,沉淀不溶解,不能确定是否有 NaCl和 KCl,因为实验三操作中加入的氯离子;
(1)所以原粉末中一定没有的两种物质是:CD; 故答案为:CD;
(2)原粉末中,一定含 的物质为EF,故答案为:EF;
(3)因为实验三操作中加入的氯离子,所以无法确定原来是否有氯离子,所以实验四和实验五用来检验氯离子的操作不需要;
故答案为:DE.
本题解析:
本题难度:简单
3、选择题 如图所示的实验中,能达到实验目的的是
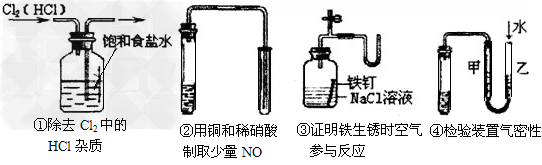
[? ]
A.①②③④?
B.②③④?
C.③④?
D.①④
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列装置所示的实验不能达到目的的是
[? ]
A.
B.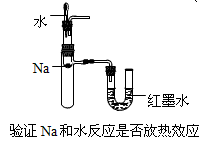
C.
D.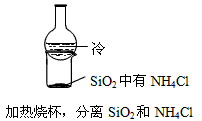
参考答案:A
本题解析:
本题难度:一般
5、简答题 某氯化铁与氯化亚铁的混合物.现要测定其中铁元素的质量分数,实验按以下步骤进行:
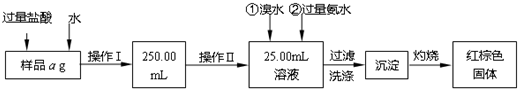
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有______、______,(填仪器名称)
(2)请写出加入溴水发生的离子反应方程式______,
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是______.
若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是______
Ⅱ.有同学提出,还可以采用以下方法来测定:
(1)溶解样品改用了硫酸,而不用盐酸,为什么______
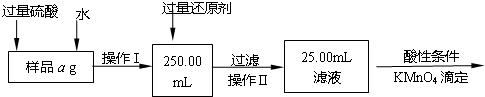
(2)选择的还原剂是否能用铁______(填“是”或“否”),原因是:______.
(3)若滴定用掉c?mol/L?KMnO4溶液bmL,则样品中铁元素的质量分数是______.
参考答案:Ⅰ、(1)因配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶;
故答案为:250mL容量瓶;胶头滴管;
(2)因Br2具有氧化性,能氧化Fe2+:2Fe2++Br2=2Fe3++2Br-;为了使Fe3+充分沉淀,氨水要过量,故答案为:2Fe2++Br2=2Fe3++2Br-;
(3)为了减少误差,需再次加热冷却并称量,直至两次质量差小于0.1g;因铁元素质量守恒,即红棕色固体中的铁就是样品中铁,Fe2O3中铁元素的质量为(W2-W1)g×112160;样品中铁元素的质量分数是1120(W2-W1)160a×100%,
故答案为:再次加热冷却并称量,直至两次质量差小于0.1g;1120(W2-W1)160a×100%;
Ⅱ.(1)高锰酸钾具有强氧化性,加入盐酸,溶液中的氯离子会被氧化,多消耗高锰酸钾,产生实验测定误差,故答案为:过量的盐酸对后面KMnO4的滴定有干扰;
(2)还原剂不能用铁,因为有贴分会和过量硫酸反应生成硫酸亚铁,再用高锰酸钾滴定,多消耗氧化剂产生误差,干扰原混合物的铁元素的测定;
故答案为:否;如果用铁做还原剂,会与过量的硫酸反应生成Fe2+,干扰铁元素的测定;
(3)依据反应5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O;依据定量关系计算得到:设铁元素质量分数为X%,
5Fe2+~5Fe3+~KMnO4
5×56? 1
a×X%×25.00250.0?c×b×10-3?
铁元素的质量分数是X%=2.8bca,故答案为:2.8bca.
本题解析:
本题难度:一般