微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列电子排布式表示基态原子电子排布的是?( ?)。
A.1s22s22p63s13p3
B.1s22s22p63s23p63d104s14p1
C.1s22s22p63s23p63d24s1
D.1s22s22p63s23p63d104s24p1
参考答案:D
本题解析:1s22s22p63s13p3属于激发态的原子的核外电子排布式,故A错误;1s22s22p63s23p63d104s14p1属于激发态的原子的核外电子排布式,故B错误;1s22s22p63s23p63d24s1?属于激发态的原子的核外电子排布式,故C错误;1s22s22p63s23p63d104s24p1属于基态原子的核外电子排布,故D正确。
点评:本题考查了基态、激发态的核外电子排布式,属于对基础知识的考查,该题比较容易。
本题难度:一般
2、填空题 下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格: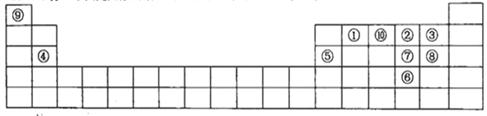
(1)在这10种元素中,非金属性最强的是?(填序号);
(2)元素②⑧⑨以原子个数比1:1:1形成的化合物的结构式为?,元素②与⑨形成的18e-化合物的电子式?;
(3)②⑨⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M中含有的化学键类型有?;
(4)比较元素⑦⑧形成的气态氢化物的稳定性:?>?(用化学式表示)
(5)元素⑤的氧化物与氢氧化钠溶液反应的离子方程式?。
(6)元素④和③形成的化合物属于?化合物,用电子式表示其形成过程?。
参考答案:(1)③;(2)H—O—Cl;?H∶O∶O∶H?;(3)离子键和共价键
(4)HCl> H2S。(5)Al2O3+2OH-=2AlO2-+H2O (6)离子 电子式形成过程
本题解析:(1)在同一周期的元素中,元素的原子序数越大,元素的非金属性越强,在不同周期的元素中,元素的原子核外的电子层数越少,元素的非金属性越强。因此在这些元素中非金属性最强的是③F元素。(2)元素O、Cl、H三元素以原子个数比1:1:1形成的化合物HClO的结构式为H—O—Cl。元素O、H形成的18e-化合物H2O2的电子式为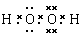 。(3)H、N、O三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M为NH4NO3。该化合物为在化合物,其中含有的化学键类型有离子键、共价键。(4)S、Cl是同一周期的元素。元素的元素半径越小,元素得到电子的能力就越强,元素的非金属性就越强。元素结合H形成的氢化物的稳定性就越强。所以稳定性HCl>H2S。(5)元素⑤是Al,其氧化物Al2O3是两性氧化物,既能与强酸反应液能与强碱发生反应。生成盐和水。Al2O3与NaOH溶液反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O。(6)④元素Mg和③元素F形成的化合物MgF2属于离子化合物,用电子式表示其形成过程为:
。(3)H、N、O三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M为NH4NO3。该化合物为在化合物,其中含有的化学键类型有离子键、共价键。(4)S、Cl是同一周期的元素。元素的元素半径越小,元素得到电子的能力就越强,元素的非金属性就越强。元素结合H形成的氢化物的稳定性就越强。所以稳定性HCl>H2S。(5)元素⑤是Al,其氧化物Al2O3是两性氧化物,既能与强酸反应液能与强碱发生反应。生成盐和水。Al2O3与NaOH溶液反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O。(6)④元素Mg和③元素F形成的化合物MgF2属于离子化合物,用电子式表示其形成过程为: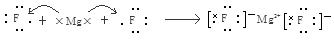 。
。
本题难度:一般
3、选择题 以下符号正确的是(?)
A.2d1
B.3f7
C.6s3
D.7p2
参考答案:D
本题解析:L层只有s、p能级,A不正确。M层只有s、p、d能级,B不正确。S能级只能容纳2个电子,C不正确,所以正确的答案选D。
本题难度:简单
4、选择题 已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是
A.气态氢化物的稳定性:D>C?B.原子序数:b>a>c>d?
C.最高价氧化物对应水化物的碱性:B>A? D.四种元素一定属于短周期元素
参考答案:B
本题解析:略
本题难度:一般
5、填空题 (6分)在第3周期中,化学性质最稳定的元素符号是?,最高价氧化物的水化物的酸性最强的化合物的化学式是?,碱性最强的化合物的化学式是?,显两性的氢氧化物的化学式是?,该两性氢氧化物与氢氧化钠溶液反应的离子方程式为?。
参考答案: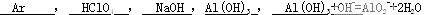
本题解析:略
本题难度:一般