微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A、B、C、D、E是短周期的五种主族元素。A元素的某种原子,其核内没有中子;B元素的基态原子2p轨道上只有一对成对电子;C与B处于同一周期,且原子半径小于B;D与C是同主族元素;E元素的一价阳离子和C元素的阴离子具有相同的电子层结构。根据上述信息回答下列问题:
(1)B元素的原子结构示意图是 ? ;C元素原子的电子排布图是 ;D元素原子的价电子排布式是 ;
(2)A元素分别与C、D两元素形成的化合物的稳定性由强到弱的顺序是(用化学式表示) ;(3)由B、D、E三种元素组成的某种化合物的水溶液能使pH试纸先变蓝后褪色,写出该化合物的化学式 ;用一个离子方程式表明该化合物水溶液使pH试纸先变蓝后褪色的原因 。
参考答案:(1) (1分);
(1分); 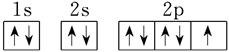 ;3s23p5
;3s23p5
(2)HF>HCl?(3)NaClO(1分);ClO-+H2O OH-+HClO?(其它每项2分)
OH-+HClO?(其它每项2分)
本题解析:A、B、C、D、E是短周期的五种主族元素。A元素的某种原子,其核内没有中子,则A是氢元素;B元素的基态原子2p轨道上只有一对成对电子,这说明2p轨道上有4个电子,则B元素氧元素;C与B处于同一周期,且原子半径小于B。根据同周期自左向右原子半径逐渐减小可知,C一定是氟元素;D与C是同主族元素,且属于短周期元素,因此D是氯元素;E元素的一价阳离子和C元素的阴离子具有相同的电子层结构,因此E是钠元素。
(1)氧元素位于周期表的第二周期第ⅥA族,所以其原子结构示意图是 ;F元素的原子序数是9,则根据构造原理、能量最低原理、洪特规则以及泡利原理可知,氟原子的电子排布图是
;F元素的原子序数是9,则根据构造原理、能量最低原理、洪特规则以及泡利原理可知,氟原子的电子排布图是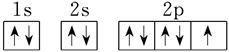 ;氯元素位于第三周期第ⅦA族,所以其原子的价电子排布式是3s23p5。
;氯元素位于第三周期第ⅦA族,所以其原子的价电子排布式是3s23p5。
(2)非金属性越强,氢化物的稳定性越强。同主族自上而下非金属性逐渐减弱,则非金属性强弱顺序是F>Cl 。因此A元素分别与C、D两元素形成的化合物的稳定性由强到弱的顺序是HF>HCl。
(3)由B、D、E三种元素组成的某种化合物的水溶液能使pH试纸先变蓝后褪色,这说明该化合物的水溶液显碱性,且还具有漂白性,因此该化合物是NaClO;次氯酸钠是强碱弱酸盐,溶于水ClO-水解溶液显碱性,水解方程式为ClO-+H2O OH-+HClO。因此用一个离子方程式表明该化合物水溶液使pH试纸先变蓝后褪色的原因为ClO-+H2O
OH-+HClO。因此用一个离子方程式表明该化合物水溶液使pH试纸先变蓝后褪色的原因为ClO-+H2O OH-+HClO。
OH-+HClO。
本题难度:困难
2、填空题 (13分)A、B、C、D、E、F都是短周期主族元素,教育博客原子系数依次增大。其中B原子最外层上的电子数是其电子层数的2倍;教育博客A能和C形成原子个数比为1:1和2:1的物质;D也能和 C形成原子个数比为1:1和2:1的物质;D、E、F元素的最高价氧化物的水化物两两皆能反应,都生成盐和水;F单质在常温下是一种气体。试回答:
(1)请写出下列元素的名称: C______,E_______, F______,
B在元素周期表中的位置是________________。
(2)B、C、F三种元素形成的氢化物中,沸点最高的是________________。(填分子式)
(3)A与C形成的含有18个电子的分子的电子式是_____________。
(4)C、 D单质形成原子个数比为1:1的化合物的化学方程式是_______________。
(5)E单质与D元素最高价氧化物的水化物反应的离子方程式是______________。
参考答案:(13分)(1)氧?铝?氯?(写符号无分 (每个1分)
第二周期IVA 族?(2分)
(2)H2O?(2分)
(3)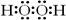 ?(2分)
?(2分)
(4)2Na+O2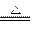 2Na2O2?(无条件扣1分)(2分)
2Na2O2?(无条件扣1分)(2分)
(5)2Al + 2OH- + 2H2O ="=" 2AlO2- + 3H2↑ (2分)
本题解析:略
本题难度:简单
3、选择题 下列各种原子的核外电子排布中,属于基态的是
A.1s 2 2s1 2p1
B.1s2 2s2 2p3 3s1
C.1s2 2s2 2p6 3s1 4s1
D.1s2 2s2 2p6 3s2 3p6 4s1
参考答案:D
本题解析:处于最低能量的原子叫做基态原子,所以选项D正确,其余选项都不是,答案选D。
本题难度:一般
4、填空题 (9分)、下表是周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
?
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0
|
1
| A
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
2
| ?
| ?
| ?
| D
| E
| ?
| G
| I
|
3
| B
| ?
| C
| ?
| F
| ?
| H
| ?
|
(1)表中元素,化学性质最不活泼的是?,只有负价而无正价的是?,氧化性最强的单质是?,还原性最强的单质是?;
(2)最高价氧化物的水化物碱性最强的是?,酸性最强的是?,呈两性的是?;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的?;
(4)在B、C、D、E、F、G、H中,原子半径最大的是?.
参考答案:(9分)(1) Ne、F、F2、Na ?(2)NaOH、HClO4、Al(OH)3?(3)HF? (4)Na
本题解析:根据元素周期表确定A为氢元素,B为钠元素,C为铝元素,D为碳元素,E为氮元素,F为磷元素,G为氟元素,H为氯元素,I为氖元素。所以化学性质最不活泼的是稀有气体Ne,只有负价而无正价的是F,氧化性最强的单质是F2 ,还原性最强的单质是Na .。根据金属性强弱判断最高价氧化物的水化物碱性最强的是NaOH,根据非金属性强弱判断最高价氧化物的水化物酸性最强的是HClO4,呈两性的是Al(OH)3,气态氢化物最稳定的是HF。根据同周期元素原子半径越往右半径越小,同主族元素原子半径越往下越大,得出(4) 原子半径最大的是Na。
本题难度:一般
5、选择题 下列说法中正确的是
A.1s电子云呈球形,表示电子绕原子核做圆周运动
B.电子云图中的小黑点密度大,说明该原子核外空间电子数目多
C.ns能级的原子轨道图可表示为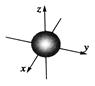
D.3d3表示3d能级有3个轨道
参考答案:C
本题解析:选项A不正确,核外电子的移动是没有规律的;选项B不正确,小黑点密度大,说明该处电子出现的机率就大;3d3表示3d能级含有3个电子,d能级含有5个轨道,选项D不正确,所以正确的答案选C。
本题难度:一般