微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 t ℃时,将3 mol A和2 mol B气体通入体积为2 L的密闭容器中(容积不变),发生反应:3A(g)+B(g)x C(g),2 min时反应达到平衡状态(温度不变),剩余1.8 mol B,并测得C的浓度为0.4 mol·L-1。请填写下列空白:
C(g),2 min时反应达到平衡状态(温度不变),剩余1.8 mol B,并测得C的浓度为0.4 mol·L-1。请填写下列空白:
(1)x=_________。
(2)用A表示该反应的速率为_________mol·L-1·min-1。
(3)若继续向平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是_________(填写下列选项字母序号)。
A.化学平衡向正反应方向移动
B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动
D.正、逆反应的化学反应速率将发生同等程度的改变
(4)在t ℃时,若向平衡混合物的容器中再充入a mol C,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入B_________mol(用含a的式子表示);达新平衡时,A的物质的量为n(A)=_________(用含a的式子表示)。
参考答案:
(1)2?(2)0.15?(3)C?(4)a/4?(2.4+0.6a) mol
本题解析:
反应前没有C,通过B、C的变化量求出x,根据同一反应反应速率之比等于化学计量数比求出A的反应速率,恒温、恒容条件下通入稀有气体容器中各物质的浓度不变平衡不移动,(4)向一边倒满足A、B的物质的量之比为3∶2,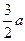 ∶[
∶[ a+n(B)]=3∶2,n(B)=
a+n(B)]=3∶2,n(B)=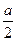 。对应成比例再次平衡时A的物质的量为:2.4 mol+
。对应成比例再次平衡时A的物质的量为:2.4 mol+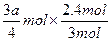 =(2.4+0.6a) mol
=(2.4+0.6a) mol
本题难度:一般
2、计算题  (Ⅰ)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)
(Ⅰ)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)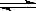 2NH3(g),其部分工艺流程如下:
2NH3(g),其部分工艺流程如下:






 回答下列问题:
回答下列问题:
 ⑴已知:N2(g)+O2(g) =2NO(g);△H=180.5kJ/mol
⑴已知:N2(g)+O2(g) =2NO(g);△H=180.5kJ/mol
 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=-905kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=-905kJ/mol
 2H2(g)+O2(g)=2H2O(g) ;△H=-483.6kJ/mol
2H2(g)+O2(g)=2H2O(g) ;△H=-483.6kJ/mol
 则N2(g)+3H2(g)
则N2(g)+3H2(g)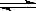 2NH3(g)的△H=_________________。
2NH3(g)的△H=_________________。


 (2)假如该厂生产的氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH_________14-a,此时c(NH4+)________c(Cl-)(填“大于”“小于”或“等于”)。
(2)假如该厂生产的氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH_________14-a,此时c(NH4+)________c(Cl-)(填“大于”“小于”或“等于”)。
Ⅱ:(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa
时,16.0gN2H4在氧气中完全燃烧生成氮气,放出热量312kJ, 写出表示N2H4燃烧热的热化学方程式是?。
写出表示N2H4燃烧热的热化学方程式是?。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。肼—空气燃料电池放电时:
正极的电极反应式是?。负极的电极反应式?。
(3)右图是一个电化学过程示意图。
①锌片上发生的电极反应是?。
②假设使用肼—空气燃料电池作为本过程中的电源,
铜片的质量变化128g,则肼一空气燃料电池理论
上消耗标准状况下的空气??L
(假设空气中氧气体积含量为20%)
参考答案:
(Ⅰ)
 (1)-92.4kJ/mol
(1)-92.4kJ/mol
(2)小于 ?等于
?等于
?
Ⅱ:(1) N2H4(l)+O2(g)=N2(g)+H2O(l);△H="-624kJ/mol?"
(2)? O2+4e-+2H2O=4OH-?, N2H4-4e-+4OH-=N2↑+4H2O?
(3)? Cu2+ + 2e -=" Cu?" ,? 112
本题解析:
(Ⅰ)根据盖斯定律可得:热化学反应方程式N2(g)+3H2(g)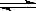 2NH3(g)的△H=180.5kJ/mol+[-(-905kJ/mol×1/2)]+[-483.6kJ/mol×3/2]=-92.4kJ/mol
2NH3(g)的△H=180.5kJ/mol+[-(-905kJ/mol×1/2)]+[-483.6kJ/mol×3/2]=-92.4kJ/mol
(2)当盐酸的pH=14-a时,它与等体积的氨水发生中和反应,溶液一定呈碱性,因氨水的量明显要过剩。现在要求二者中和反应后,混合液呈现中性,则盐酸的浓度要大一点,故溶液的PH小于14-a;根据电荷守恒可知。c(H+)+c(NH4+)=c(OH-)+c(Cl-),现溶液呈中性,故c(H+)=c(OH-),得c(Cl-)=c(NH4+)。
(Ⅱ)(1)由16.0gN2H4完全燃烧放出热量312kJ,可求出1mol肼完全燃烧所放出的热量为624k,故表示它的燃烧热的热化学方程式为N2H4(l)+O2(g)=N2(g)+H2O(l);△H="-624kJ/mol"
(2)由肼—空气燃料电池是一种碱性燃料电池可知,正极反应为 O2+4e-+2H2O=4OH-,负极反应可用总电极反应式减去正极反应式(电量守恒时),可得负极反应式为 N2H4-4e-+4OH-=N2↑+4H2O 。
(3)铜的质量变化为128g,由Cu-2e-=Cu2+,可知在电路中通过的电量为128g/64g.mol-1×2=4mole-,根据电量守恒,现电量由反应式 N2H4(l)+O2(g)=N2(g)+H2O(l)提供,故可得消耗1molO2(g),空气为5V(O2)=5×22.4L=112L。
本题难度:一般
3、选择题 化学平衡状态是指
[? ]
A.反应不再发生
B.在一定条件下,反应混合物中各组成成分的浓度不随时间改变
C.反应容器内的总压强保持不变
D.反应物的转化率不再变化
参考答案:BD
本题解析:
本题难度:简单
4、选择题 将2mol?SO2和1mol?O2充入一容积固定的密闭容器中,在一定条件下反应:
2SO2(g)+O2(g)

?2SO3(g),下列哪些情况能说明该可逆反应已达化学平衡状态的是( )
A.每生成2molSO2的同时,消耗2molSO3
B.混合气体的质量不再变化
C.每生成2molSO3的同时,消耗2molSO3
D.每生成2molSO3的同时,消耗1molO2
参考答案:A、无论该反应是否达到平衡状态,每生成2molSO2的同时消耗2molSO3,故A错误.
B、根据质量守恒,无论该反应是否达到平衡状态,反应前后混合物的质量不变,故B错误.
C、反应达到平衡状态时,每生成2molSO3的同时,消耗2molSO3,三氧化硫的正逆反应速率相等,所以达到平衡状态,故C正确.
D、无论该反应是否达到平衡状态,每生成2molSO3的同时消耗1molO2,故D错误.
故选C.
本题解析:
本题难度:一般
5、选择题 2008北京奥运会前后,北京市政府出台了机动车单双号限行的措施,空气质量得到明显改善。已知NO和CO都是汽车尾气中的主要有害物质,它们能缓慢地反应生成N2和CO2:NO+CO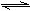 N2+CO2。有关该反应的下列叙述正确的是(?)?
N2+CO2。有关该反应的下列叙述正确的是(?)?
A.使用催化剂不能改变反应速率
B.降低压强有害物质转化的程度增大
C.改变压强对反应速率无影响
D.升高温度使反应速率加快
参考答案:D
本题解析:对于一个化学反应,通常都有加快其反应速率的催化剂;对于有气体参加的化学反应,压强会对反应速率造成影响;温度对任何化学反应的速率都会造成影响;该反应中反应前后气态物质分子总数不变,降低压强不影响平衡移动,也就不影响有害物质的转化程度。
本题难度:简单