微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数,并探究铁与浓硫酸的反应。
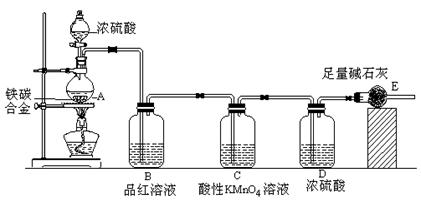
(1)m克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是①常温下碳与浓硫酸不反应;②?。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式?。
(3)B中的现象是:?;
C的作用是:?。
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为??(写含m、b的表达式)。
⑸反应一段时间后,用滴管吸取A中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:
A:只含有Fe3+;B:只含有Fe2+;C:?。
验证C的实验方法是?
?。
参考答案:(1)?常温下Fe遇浓硫酸发生钝化?(1分)
(2) C + 2H2SO4(浓)  ?CO2↑ + 2SO2↑ + 2H2O(2分)
?CO2↑ + 2SO2↑ + 2H2O(2分)
(3) 品红溶液褪色,或“颜色变浅” (1分) 除尽反应产物中的SO2气体?(1分)
(4)(11m-3b)/11m?(2分)
⑸既有Fe3+又有Fe2+?(1分)
取试样少许于试管中,先滴加少量的KSCN溶液,振荡后溶液显红色证明有Fe3+?(1分);再取试样少许于另一支试管中,滴加少量的酸性KMnO4溶液,若浅红色褪去,证明溶液中含有Fe2+(1分)。?(2分,检验Fe3+ 1分,检验Fe2+ 1分)
本题解析:(1)依据铁在常温下在浓硫酸中钝化,碳和浓硫酸需要加热反应分析可知,往铁碳合金中加入浓硫酸,未点燃酒精灯前,A、B均无明显现象。
(2)碳和浓硫酸加热反应生成二氧化碳、二氧化硫和水,则化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,
CO2↑+2SO2↑+2H2O,
(3)气体中含有二氧化硫,通过品红溶液会褪色,通过高锰酸钾溶液可以除去二氧化硫,避免干扰二氧化碳的测定。
(4)根据CO2+Ca(OH)2=CaCO3↓+H2O,E增重b g,可算出碳的质量有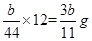 ?g,则铁的质量分数:
?g,则铁的质量分数: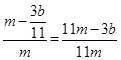
(5)由A、B假设可推出C假设为:既有Fe3+又有Fe2+;可用KSCN检验Fe3+、然后用酸性KMnO4溶液检验Fe2+。
本题难度:困难
2、选择题 硫元素的非金属性弱于氯元素的事实是:
A.通常情况下硫为浅黄色固体,而氯气为黄绿色的气体
B.硫不溶于水而氯气溶于水
C.跟金属或氢气反应时,硫被还原为-2价,而氯被还原为-1价
D.跟Cu或Fe反应时,金属被硫氧化成低价态,而被氯氧化成高价态
参考答案:D
本题解析:硫为浅黄色固体,而氯气为黄绿色的气体只是物质的外部特点,不能用来作为判断非金属性强弱的依据,故A错误,硫不溶于水而氯气溶于水只是物质的外部特点,也不能用来作为判断非金属性强弱的依据;跟金属或氢气反应时,硫被还原为-2价,而氯被还原为-1价,因为两种元素被还原时,分别都是-2价和-1价,故不能用来作为判断非金属性强弱的依据,故C错误,D正确。
点评:本题考查了元素非金属性强弱的比较,该题四个选项的描述都是正确的,但是要通过本质看现象,才能选择正确的答案,该题有一定的难度。
本题难度:简单
3、选择题 “飘尘”是物质燃烧时产生的粒状漂浮物,颗粒很小(直径小于10-7 m),不易沉降(可漂浮数小时甚至数年),它与空气中的SO2、O2接触时,SO2会转化为SO3,使空气酸度增加。飘尘所起的主要作用与下列变化中硫酸的作用相同的是( )。
A.氯气除杂过程中通入浓硫酸中
B.浓硫酸与木炭共热
C.乙酸乙酯与稀硫酸共热
D.浓硫酸滴到蔗糖中制“黑面包”
参考答案:C
本题解析:“飘尘”与空气中的SO2、O2接触时,SO2会转化为SO3,则“飘尘”在该反应中起催化作用。氯气通入浓硫酸中除水蒸气,浓硫酸表现了吸水性;浓硫酸与木炭共热,浓硫酸表现了强氧化性;乙酸乙酯与稀硫酸共热时,乙酸乙酯水解,稀硫酸起催化作用;浓硫酸滴到蔗糖中制“黑面包”时,浓硫酸表现了脱水性。
本题难度:一般
4、实验题 写出CO2气体与Na2O2反应的化学方程式。某学生欲通过实验来探索SO2和Na2O2反应的产物,请你协助完成下列假设与设计:
(1)从SO2和Na2O2双方的性质出发,推测彼此反应的产物,写出虚拟反应式。
(2)画出完成此项实验的装置图。
(3)说明装置各部分所起的作用或添置它的目的。
(4)如何确认二者反应的产物?
参考答案:2CO2+2Na2O2====2Na2CO3+O2? (1)SO2+Na2O2====Na2SO4
(2)见下图:
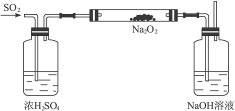
(3)前一洗气瓶中浓硫酸用于干燥SO2,以防水蒸气与Na2O2反应;中间玻璃管用于SO2与Na2O2反应;后一洗气瓶一是吸收未反应的SO2,二是检验有无O2生成。
(4)将Na2O2反应后的固体溶于水后,加盐酸酸化的BaCl2溶液,如有沉淀生成则说明生成的产物为Na2SO4。
本题解析:SO2有较强的还原性,Na2O2有较强的氧化性,二者发生氧化还原反应,产物只能为Na2SO4。
本题难度:简单
5、实验题 已知硫化氢气体可与溴水反应生成硫,下图是用来制取硫化氢并比较硫元素、溴元素非金属性强弱的实验装置。
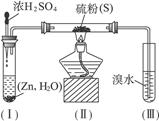
(1)将下列操作步骤补充完整:
①______________________________________________;
②用大火加热使硫沸腾与H2化合;
③______________________________________________;
④停止加热并做善后处理。
(2)装置(Ⅰ)中制氢气不直接用稀硫酸与锌反应,而将浓H2SO4滴入水中,其优点是__________________________________。
(3)装置(Ⅲ)中发生的现象是_______________________________,由此得出的结论是_____________________,反应的离子方程式为____________________________________。
参考答案:(1)①检查装置气密性,挤压胶头滴管使浓H2SO4滴入试管,并检验H2的纯度
③待装置(Ⅲ)中的溴水褪色,并产生浑浊时撤去导管
(2)利用浓H2SO4溶于水时放出的热,加速H2的生成
(3)溴水褪色,产生淡黄色浑浊?溴的非金属性比硫强Br2+H2S====S↓+2H++2Br-
本题解析:由于H2S有毒,H2易燃易爆,因此操作的第一步应是检查装置气密性和检验H2的纯度,反应结束时,为防止(Ⅲ)内液体被倒吸,应先撤去导管再停止加热 。用浓H2SO4与用稀H2SO4的区别在于浓H2SO4有一个稀释的过程,其稀释时放出大量热,可以加快反应的进行。
本题难度:简单