微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列材料最不适宜储运浓硫酸、浓硝酸的是
A.铁
B.铜
C.陶瓷
D.铝
参考答案:B
本题解析:浓硫酸、浓硝酸均具有强氧化性,但常温下铁、铝和浓硫酸、浓硝酸会发生钝化,因此可以铁制容器或铝制容器来储运浓硫酸、浓硝酸;陶瓷属于无机非金属材料,主要成分是二氧化硅,二氧化硅性质稳定不溶于浓硫酸、浓硝酸,因此页可以用来储运浓硫酸、浓硝酸;铜和浓硫酸需要加热才能发生氧化还原反应,和浓硝酸在常温下即可被氧化,因此铜制容器不能用来储运浓硫酸、浓硝酸。
本题难度:简单
2、实验题 下图为某套实验装置示意图,无法看到实验说明,加热装置已经省略.
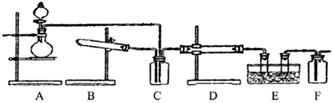
(一)甲同学认为当D处盛放V2O5作催化剂时,此套装置可用于合成物质X,并预测E处冰水冷却的U型管中将有固体X出现.
(1)事实上此装置所附实验说明符合甲同学的推断,那么A中所发生的反应的化学反应方程式是:__________,C装置中盛放的液体药品的名称是______________。
(2)甲同学方案中为了提高A装置产物的转化率,可以增大B装置产物的通入量,欲知A、B两装置中产物在D中的通入量,可通过观察__________得知.
(3)本实验在设计上_________(填有、无)缺失之处?若有请给出改进方案。(若无,此问可不答)
(二)乙同学认为若D处盛放铂铑合金网作催化剂,则此套装置也可用于合成物质Y,并预测E处冰水冷却的U型管中将有红棕色气体生成,且越接近U型管底部颜色越浅.
(4)写出乙同学认为的D装置中发生反应的化学方程式_________________________________。
(5)对于A处,乙认为不需加热装置。则A处仪器中分别放置的药品为:分液漏斗中____________圆底烧瓶中_________
(6)若要用上述装置完成乙同学所认为的实验,且C处所起作用与合成X时所起作用基本一致,那么C处的广口瓶应改为__________所装药品为_____________。
参考答案:
(1)Na2SO3+H2SO4?Na2SO4+H2O+SO2↑; 浓硫酸?
(2)C中两导管口气泡的逸出速率
(3)有; 应在E与F之间连接一个防倒吸装置
(4)4NH3+5O2 4NO+6H2O(2NO+O2?2NO2不写也可以)
4NO+6H2O(2NO+O2?2NO2不写也可以)
(5)浓氨水; 固体NaOH(或生石灰或碱石灰)
(6)U形管或干燥管; 碱石灰
本题解析:
(1)V2O5是SO2氧化为SO3的催化剂。所以该装置是用于合成SO3的装置。A是制取SO2的装置,在A中所发生的反应的化学反应方程式Na2SO3+H2SO4=Na2SO4+H2O+SO2↑; B是制取O2的装置,反应原理为2KClO3 2KCl+3O2↑。在装置C中装有浓硫酸,其作用是一是干燥气体;二是通过观察气泡来混合气体。
2KCl+3O2↑。在装置C中装有浓硫酸,其作用是一是干燥气体;二是通过观察气泡来混合气体。
(2)反应2SO2+ O2 2SO3是可逆反应,为了提高SO2的转化率,可以通过增大O2的浓度的方法来实现。欲知A、B两装置中产物在D中的通入量,可通过观察C装置中两导管口气泡的逸出速率得知.
2SO3是可逆反应,为了提高SO2的转化率,可以通过增大O2的浓度的方法来实现。欲知A、B两装置中产物在D中的通入量,可通过观察C装置中两导管口气泡的逸出速率得知.
(3)本实验在设计上有缺陷。由于E降温导致整个装置中的气体压强减小,这样F中的液体容易倒吸至装置E中,导致实验失败。改进的措施是在E与F之间连接一个防倒吸装置。
(4)铂铑合金网作催化剂是氨气催化氧化的催化剂。A装置用于制取氨气,反应的方程式为:Ca(OH)2+2NH4Cl 2NH3↑+2H2O+CaCl2,B装置用于制取O2,反应的方程式为:2KClO3
2NH3↑+2H2O+CaCl2,B装置用于制取O2,反应的方程式为:2KClO3  ?2KCl+3O2↑。在C装置中干燥并混合气体,在D中发生反应:4NH3+5O2
?2KCl+3O2↑。在C装置中干燥并混合气体,在D中发生反应:4NH3+5O2 4NO+6H2O。在E中发生反应2NO+O2=2NO2得到红棕色的NO2。
4NO+6H2O。在E中发生反应2NO+O2=2NO2得到红棕色的NO2。
(5)对于A处,若不需加热装置。则A处仪器中分别放置的药品为:分液漏斗中装浓氨水,圆底烧瓶中CaO、Ca(OH)2、NaOH、碱石灰等有吸水性的物质。这些物质吸水放热,可以使一水合氨分解产生氨气。
(6)由于氨气是碱性气体,所以若要用上述装置完成乙同学所认为的实验,且C处所起作用与合成X时所起作用基本一致,那么C处的广口瓶应改为U形管或干燥管; 所装药品为碱性干燥剂如碱石灰3、NO的原料气的制取、混合、干燥、合成、注意事项等实验操作和反应原理等知识。
本题难度:一般
3、实验题 已知:SO2可以与硫酸酸化的浓KMnO4溶液反应,也可以使澄清的石灰水变浑浊。下图④中浓硫酸与木炭粉在加热条件下发生反应生成?CO2、SO2和H2O。

(1)在加热条件下,浓硫酸与木炭粉反应的化学方程式是:?。(2分)
(2)若用上图所列各装置设计一个实验,验证浓硫酸与木炭粉反应的产物,这些装置的连接顺序
(按产物气流从左至右的方向)是(填装置的编号)?→?→?→?。(2分)
(3)B瓶溶液的作用是?。(2分)本实验中能说明二氧化硫具有漂白性的实验现象是?。(2分)③中反应的离子方程式为?。(2分)
(4)装置②中所盛是无水硫酸铜,现象是?。(2分)
参考答案:(1)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O?(2)④②①③
CO2↑+2SO2↑+2H2O?(2)④②①③
(3)除去SO2;A中品红溶液褪色;CO2+Ca2++2OH-=H2O+CaCO3↓
(4)由白色变为蓝色
本题解析:(1)浓硫酸具有强氧化性,在加热的条件下与木炭发生反应的化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
(2)浓硫酸与木炭共热化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,生成CO2、SO2和H2O,依次检验CO2、SO2和H2O的存在时,应先检验水蒸气的存在,因为在验证二氧化碳、二氧化硫的存在时都需通过溶液,可带出水蒸气;二氧化碳、二氧化硫都能使澄清的石灰水变浑浊,所以不能先通过澄清的石灰水来检验二氧化碳的存在,所以先检验二氧化硫的存在并除去二氧化硫后才检验二氧化碳的存在,即检验过程应为检验水蒸气→检验并除尽二氧化硫→检验二氧化碳;无水硫酸铜为白色固体,遇水变蓝,可用于检验水;SO2能使红色的品红溶液褪色,CO2不能使红色的品红溶液褪色,因此装置A中盛有红色的品红溶液来检验二氧化硫;二氧化硫影响二氧化碳的检验,因此检验二氧化碳前先除尽二氧化硫,装置B中盛有的酸性高锰酸钾溶液除去二氧化硫,而不除去二氧化碳,装置C中的红色的品红溶液是用来证明SO2气体已完全除尽的;二氧化碳的检验方法为通过澄清的石灰水,使澄清的石灰水变浑浊,所以正确的连接顺序为④②①③。
CO2↑+2SO2↑+2H2O,生成CO2、SO2和H2O,依次检验CO2、SO2和H2O的存在时,应先检验水蒸气的存在,因为在验证二氧化碳、二氧化硫的存在时都需通过溶液,可带出水蒸气;二氧化碳、二氧化硫都能使澄清的石灰水变浑浊,所以不能先通过澄清的石灰水来检验二氧化碳的存在,所以先检验二氧化硫的存在并除去二氧化硫后才检验二氧化碳的存在,即检验过程应为检验水蒸气→检验并除尽二氧化硫→检验二氧化碳;无水硫酸铜为白色固体,遇水变蓝,可用于检验水;SO2能使红色的品红溶液褪色,CO2不能使红色的品红溶液褪色,因此装置A中盛有红色的品红溶液来检验二氧化硫;二氧化硫影响二氧化碳的检验,因此检验二氧化碳前先除尽二氧化硫,装置B中盛有的酸性高锰酸钾溶液除去二氧化硫,而不除去二氧化碳,装置C中的红色的品红溶液是用来证明SO2气体已完全除尽的;二氧化碳的检验方法为通过澄清的石灰水,使澄清的石灰水变浑浊,所以正确的连接顺序为④②①③。
(3)根据以上分析可知B瓶溶液的作用是除去SO2;本实验中能说明二氧化硫具有漂白性的实验现象是A中品红溶液褪色;③中反应的离子方程式为CO2+Ca2++2OH-=H2O+CaCO3↓。
(4)硫酸铜吸水变为胆矾,则装置②中所盛是无水硫酸铜,现象是由白色变为蓝色,
本题难度:一般
4、选择题 向下列溶液中通入足量SO2的过程中,一定不会产生沉淀的是?(?)
A.Ba(OH)2
B.Ba( NO3)2
C.Na2S
D.BaCl2
参考答案:D
本题解析:略
本题难度:一般
5、选择题 将等体积的SO2和Cl2充分混合,通入加有品红的氯化钡溶液,可观察到的现象是(? )
A.溶液快速褪色
B.溶液缓慢褪色
C.生成白色沉淀
D.生成浅黄色沉淀
参考答案:C
本题解析:
正确答案:C
Cl2+SO2+2H2O=H2SO4+2HCl,失去漂白性,生成的H2SO4与BaCl2生成沉淀。
本题难度:简单