微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 联氨(N2H4)及其衍生物是一类重要的火箭燃料.N2H4与N204反应能放出大量的热.
(1)已知:2N02(g)═N204(g)△H=一57.20kJ?mol-.一定温度下,在密闭容器中反应2N02(g)?
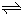
?N204(g)达到平衡.其他条件不变时,下列措施能提高NOz转化率的是______(填字母)
A.减小N02的浓度?B.降低温度?C.增加N02的浓度?D.升高温度
(2)17℃、1.0I×105Pa,2L密闭容器中N204和N02的混合气体达到平衡时,存在O.0600molN02,0.0240mol?N204.则此反应2N02(g)
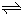
N204(g)的平衡常数K______;
若减少容器体积,则平衡常数K______(填“增大”、“减小”或“不变”).
若升高体系温度,则平衡常数K______(填“增大”、“减小”或“不变”).
参考答案:(1)该反应是反应前后气体体积减小的、放热的可逆反应,要使该反应向正反应方向移动,可改变反应物的浓度、体系的压强、温度等.
A、减小N02的浓度,平衡向逆反应方向移动,N02的转化率降低,故A错误;
B.降低温度,平衡向正反应方向移动,N02的转化率提高,故B正确;
C.增加N02的浓度,平衡向正反应方向移动,且体系压强增大,也利于反应向正反应方向移动,故C正确;
D.升高温度,平衡向逆反应方向移动,N02的转化率降低,故D错误;
故答案为:BC;
(2)C(NO2)=O.0600mol2L=0.0300 mol/L,C(N2O4)=0.0240mol?2L=0.0120mol/L;
K=C(N204)C(NO2)2=0.01200.0300?×0.0300?=13.3,
若减少容器体积,体系压强增大,平衡向正反应方向移动,但化学平衡常数不变,
若升高体系温度,平衡向逆反应方向移动,C(NO2)增大,则平衡常数K减小,
故答案为:13.3;不变;减小.
本题解析:
本题难度:一般
2、选择题 对于平衡CO2(g) CO2(aq);ΔH=-19.75?kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是
CO2(aq);ΔH=-19.75?kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是
[? ]
A.升温增压
B.降温减压
C.升温减压? ?
D.降温增压
参考答案:D
本题解析:
本题难度:一般
3、填空题 (10分)两种气态单质X和Y能直接化合生成Z(可逆反应),如将X和Y按一定比例混合并压入密闭容器中,在不同温度下经过一段时间后,反应混合物中X的含量变化如下图所示,回答下列问题:
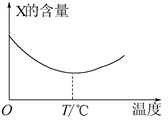
(1)上述X与Y化合生成Z的反应是__________反应(填“放热”或“吸热”);
(2)温度低于T℃时,反应混合物中X的含量 (填“逐渐增大”,“不变”,“逐渐减小”),原因是______________________________;温度高于T℃时,反应混合物中X的含量__________(填“逐渐增大”,“不变”,“逐渐减小”),原因是________________。
参考答案:.(1)放热
(2)逐渐减少 随着反应进行,反应物浓度逐渐减小
逐渐升高 升温,平衡向逆反应方向移动
本题解析:(1)X的含量最小时,说明反应达到平衡状态,再升高温度,X的含量增加,说明升高温度,平衡逆向移动,所以该反应是放热反应;
(2)根据图像可知,温度低于T℃时,反应混合物中X的含量逐渐减小,因为随反应的进行,反应物逐渐消耗,所以浓度逐渐减小;温度高于T℃时,反应混合物中X的含量逐渐增大,说明达平衡后升高温度,平衡逆向移动,X的浓度逐渐增大。
考点:考查对图像的分析,平衡的判断
本题难度:一般
4、选择题 下列有关工业生产的叙述错误的是
[? ]
A.合成氨工业用铁触媒作催化剂,可加快正、逆反应速率
B.合成氨工业对原料气进行压缩,可增大原料气的转化率
C.硫酸工业中,采取通入适当过量的空气,以提高SO2的转化率
D.硫酸工业中,在催化反应室安装热交换装置可利用SO3转化为H2SO4时放出的热量
参考答案:D
本题解析:
本题难度:一般
5、选择题 对化学反应限度的叙述,错误的是
[? ]
A.任何可逆反应都有一定的限度
B.化学反应的限度是不可改变的
C.化学反应的限度与时间的长短无关
D.化学反应达到限度时,正逆反应速率相等
参考答案:B
本题解析:
本题难度:简单