微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知浓H2SO4和Fe3+都可以将Cu氧化(Fe3+与Cu的反应为:2Fe3+ + Cu = 2Fe2+ + Cu2+),浓H2SO4还可以将Br-氧化成Br2,Fe与Br2反应生成FeBr3,则有关物质氧化性强弱的顺序为?
A.H2SO4(浓) > Cu2+ > Fe3+ > Br2
B.H2SO4(浓) > Br2 > Fe3+ > Cu2+
C.Br2 > H2SO4(浓) > Cu2+ > Fe3+
D.Cu2+ > Fe3+ > Br2 > H2SO4(浓)
参考答案:B
本题解析:本题是比较氧化性强弱,运用氧化剂的氧化性大于氧化产物,区分氧化剂和氧化产物;氧化剂:反应物中含有元素化合价降低的物质;氧化产物:还原剂失去电子后(化合价升高)所得的产物,由题干可知:氧化性H2SO4(浓) > Cu2+, Fe3+ > Cu2+,H2SO4(浓) > Br2,Br2 > Fe3+,综上所述,H2SO4(浓) > Br2 > Fe3+ > Cu2+,A.错误;B.正确;C.错误;D.错误。
本题难度:一般
2、选择题 根据反应方程式① 2Fe3+ +2I
参考答案:
本题解析:
本题难度:一般
3、填空题 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好。(e处反应的化学方程式为:2KMnO4+16HCl===2MnCl2+5Cl2↑+8H2O)
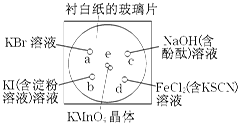
(1)e处反应中被氧化的HCl与参加反应的HCl的物质的量之比为 。
(2)b处的实验现象为___________________________________。
(3)c处反应的化学方程式为_____________________________________,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为 mol。
(4)通过该实验比较Cl2、FeCl3、KMnO4三种物质氧化性由强到弱的顺序是 。
参考答案:(1) 5∶8;(2)溶液由无色变为蓝色;(3)Cl2+2NaOH===NaCl+NaClO+H2O 0.01
(4)KMnO4>Cl2>FeCl3 。
本题解析:(1)在e处KMnO4与浓盐酸发生反应产生氯气,反应的方程式是2KMnO4+16HCl===2MnCl2+5Cl2↑+8H2O。在该反应中,16mol的HCl参加反应,有10魔力岛HCl中的Cl化合价升高失去,电子,被氧化变为氯气;有6mol的HCl仍然是以-1价的Cl存在,表现出酸性,与金属阳离子结合形成盐,所以反应中被氧化的HCl与参加反应的HCl的物质的量之比为10:16=5:8;(2)产生的氯气与KI淀粉溶液发生反应:Cl2+2KI===2KCl+I2 ,产生的I2 遇淀粉,溶液变为蓝色,因此b处的实验现象为溶液由无色变为蓝色;(3)c处氯气与碱发生歧化反应,反应的化学方程式为Cl2+2NaOH===NaCl+NaClO+H2O;根据方程式可知:每有1mol的氯气被吸收,转移1mol的电子,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,由于氯气的物质的量是0.01mol,所以转移电子的物质的量为0.01mol。(4)在氧化还原反应中,氧化性:氧化剂大于氧化产物。根据方程式2KMnO4+16HCl===2MnCl2+5Cl2↑+8H2O可知,氧化性:KMnO4>Cl2;根据反应:Cl2+FeCl2= FeCl3可知氧化性:Cl2>FeCl3 。所以该实验比较三种物质氧化性由强到弱的顺序是KMnO4>Cl2>FeCl3 。
考点:考查微型化学实验在物质的反应中氧化性强弱比较、反应现象、电子转移、气体吸收的作用的知识。
本题难度:一般
4、选择题 常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2++H2O2+2H+="==" 2Fe3++2H2O 2Fe3++H2O2 ="==" 2Fe2++O2↑+2H+
下列说法正确的是
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.H2O2分解的总方程式为:H2O2===H2O+O2↑
D.H2O2生产过程要严格避免混入Fe2+