微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质中属于盐的是
A.MnO2
B.Zn(OH)2
C.Ca(ClO3)2
D.O2
参考答案:C
本题解析:分析:根据酸是指在电离时产生的阳离子全部是氢离子的化合物;碱是指在电离时产生的阴离子全部是氢氧根离子的化合物;盐是由金属离子(或铵根离子)和酸根离子组成的化合物;氧化物是指有两种元素组成且一种是氧元素的化合物;单质是只有一种元素组成的纯净物;据此结合物质的组成进行分析判断.
解答:A.MnO2是由锰元素和氧元素组成的化合物,属于氧化物,故A错误;
B.Zn(OH)2是由锌离子和氢氧根离子组成的化合物,属于碱,故B错误;
C.Ca(ClO3)2是由钙离子和氯酸根离子组成的化合物,属于盐,故C正确;
D.O2只有一种元素组成,属于单质,故D错误;
点评:本题考查了物质类别的判别,抓住酸、碱、盐、氧化物的特征是正确解答本题的关键,题目难度不大.
本题难度:一般
2、选择题 做蒸馏实验时用到铁架台和单孔胶塞的个数分别为
A.1个和2个
B.2个和2个
C.2个和3个
D.2个和4个
参考答案:C
本题解析:分析:根据蒸馏实验的装置中,通过铁架台固定蒸馏烧瓶和冷凝管,温度计固定于单孔胶塞用来测量蒸汽的温度,冷凝管的两端分别用单孔胶塞连接烧瓶和牛角管.
解答:在做蒸馏实验时用到铁架台有2处:固定蒸馏烧瓶和冷凝管,单孔胶塞分别用于固定温度计、连接冷凝管的两端,共3处,故选:C.
点评:本题主要考查了蒸馏实验装置,熟悉装置是解题的关键.
本题难度:简单
3、选择题 在硫酸铝、硫酸钾和明矾[KAl(SO4)2?12H2O]的混合溶液中,SO42-的浓度为0.4mol/L,当加入等体积0.4mol/L?KOH溶液时,生成的沉淀恰好完全溶解.则原溶液中K+的浓度约为
A.0.225mol/L
B.0.25mol/L
C.0.45mol/L
D.0.5mol/L
参考答案:D
本题解析:分析:根据当加入等体积0.4mol/L?KOH溶液时,生成的沉淀恰好完全溶解,发生反应Al3++4OH-=AlO2-+2H2O,设体积均为1L,求出原溶液中铝离子、硫酸根的物质的量,根据电荷守恒计算原溶液中钾离子的物质的量,再根据c= 计算.
计算.
解答:设体积均为1L,由于生成沉淀完全溶解,所以反应为
Al3++4OH-=AlO2-+2H2O
?1?4
?X?0.4mol
得x=0.1mol,即含有0.1molAl3+,
原溶液中只含有K+,Al3+和SO42-,根据电荷守恒,则
n(K+)+3n(Al3+)=2n(SO42-),而n(Al3+)=0.1mol,n(SO42-)=0.4mol,
所以n(K+)+3×0.1mol=2×0.4mol,得n(K+)=0.5mol,
故c(K+)=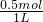 =0.5mol/L,
=0.5mol/L,
故选D.
点评:本题考查有关混合物的计算,题目浓度不大,注意根据质量守恒和电荷守恒的角度解答.
本题难度:一般
4、选择题 设NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,11.2?L氧气所含的氧原子数为NA
B.标准状况下,11.2?L?S03中含1.5NA个氧原子
C.1.8g重水(D20)中含0.9NA个中子
D.10g氖气中所含的原子数为NA
参考答案:C
本题解析:分析:A.常温常压下,气体摩尔体积不是22.4L/mol;
B.标准状况下,SO3是固体;
C.根据n=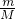 计算1.8g重水(D2O)的物质的量,每个D2O分子中含有10个中子,据此计算中子物质的量,再根据N=nNA计算中子数目;
计算1.8g重水(D2O)的物质的量,每个D2O分子中含有10个中子,据此计算中子物质的量,再根据N=nNA计算中子数目;
D.根据n=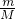 计算10g氖气的物质的量,氖气是单原子分子,再根据N=nNA计算氖原子数目.
计算10g氖气的物质的量,氖气是单原子分子,再根据N=nNA计算氖原子数目.
解答:A.常温常压下,气体摩尔体积不是22.4L/mol,由pV=nRT可知,气体摩尔体积大于22.4L/mol,11.2?L氧气的物质的量小于0.5mol,所含的氧原子数小于NA,故A错误;
B.标准状况下,SO3是固体,不能利用气体摩尔体积计算其物质的量,11.2LS03的物质的量远远大于0.5mol,故B错误;
C.1.8g重水(D2O)的物质的量为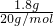 =0.09mol,每个D2O分子中含有10个中子,含有中子物质的量为0.09mol×10=0.9mol,含有中子数目为0.9mol×NAmol-1=0.9NA,故C正确;
=0.09mol,每个D2O分子中含有10个中子,含有中子物质的量为0.09mol×10=0.9mol,含有中子数目为0.9mol×NAmol-1=0.9NA,故C正确;
D.10g氖气的物质的量为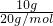 =0.5mol,氖气是单原子分子,故含有氖原子数目为0.5mol×1×NAmol-1=0.5NA,故D错误;
=0.5mol,氖气是单原子分子,故含有氖原子数目为0.5mol×1×NAmol-1=0.5NA,故D错误;
故选C.
点评:本题考查常用化学计量的有关计算,难度不大,注意气体摩尔体积的使用条件与对象,注意标准状况下,SO3是固体.
本题难度:困难
5、选择题 在标况下,下列气体含有的分子数最多的是
A.17g NH3
B.67.2L Cl2
C.4g H2
D.0.5mol SO2
参考答案:B
本题解析:分析:计算各物质的物质的量,根据N=nNA可知,物质的量越大,分子数目越多.通过比较物质的量判断.
解答:A、17g氨气的物质的量为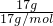 =1mol,
=1mol,
B、标准状况下,67.2L的氯气的物质的量为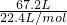 =3mol,
=3mol,
C、4g氢气的物质的量为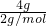 =2mol,
=2mol,
D、0.5mol SO2.
所以各物质的物质的量为B>C>A>D.
故选:B.
点评:考查常用化学计量的有关计算,难度不大,注意公式的运用与基础知识的掌握.
本题难度:一般