微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 室温时,将一定量的醋酸和氢氧化钠溶液混合,充分反应后,对于所得溶液的叙述一定正确的是
A.若pH < 7 ,则c (CH3COO -)>c(Na +)>c( H + )>c (OH -)
B.若pH =7,且V(酸)=V(碱),则c( 酸)>c(碱)
C.若pH > 7,且V(酸)=V(碱),则c( 酸)< c(碱)
D.无论溶液的酸碱性如何,溶液中均只含有下列微粒:CH3COO-、Na+、H+、OH- CH3COOH
参考答案:B
本题解析:A 错误,若pH < 7,也可能出现:c (CH3COO -)>c( H + )>c(Na +)>c (OH -)
B 正确,若pH =7,显中性,醋酸是弱酸,氢氧化钠是强碱,且V(酸)=V(碱),只有c( 酸)>c(碱)才成立。
C 错误,若pH > 7,且V(酸)=V(碱),则c( 酸)= c(碱)也成立
D 错误,溶液中还存在H2O分子。
本题难度:一般
2、填空题 (每空3分,共12分)常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下:

(1)甲组实验中HX为弱酸,a______7(填“<”,“=”或“>”)。
(2)乙组实验中HY为强酸,则HY溶液的pH=?。
(3)丙组实验发生反应的离子方程式为?,
所得溶液中由水电离出的c(OH-) =?mol/L。
参考答案:
本题解析:略
本题难度:一般
3、选择题 常温下,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液②NaOH溶液③CH3COONa溶液,下列说法中不正确的是(忽略混合前后溶液体积变化)…………………(?)
A.溶液的pH值:②>③>①
B.水电离出的c(OH-):③>①>②
C.①和②等体积混合后的溶液:c(CH3COOH)+ c(CH3COO-)=0.1mol/L
D.②和③等体积混合后的溶液:c(Na+)+ c(H+)=c(OH-)+c(CH3COO-)
参考答案:C
本题解析:①、②、③分别是弱酸、强碱、盐? A对
水电离出的c(OH-)受①电离出H+、②电离出的OH-、③水解出的OH-的影响 B对
①和②反应生成水,溶液总质量增加,n不变,c一定变小,C 错
溶液的阴阳离子平衡,D对
本题难度:一般
4、填空题 7分)某温度(t℃)时,水的KW=1×10-13,则该温度(填大于、等于或小于)?25℃,理由是?。
将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
(1)若所得混合溶液为中性,则a:b=?;
(2)若所得混合溶液pH=2,则a:b=?。
参考答案:

本题解析:略
本题难度:一般
5、选择题 常温下,将0.1 mol·L-1盐酸溶液与0.06 mol·L-1氢氧化钡溶液等体积混合,该混合溶液的pH等于(? )
A.1.7
B.2.0
C.12.0
D.12.4
参考答案:C
本题解析:氢氧化钡是二元强碱,所以氢氧化钡是过量的,则反应后OH-的浓度是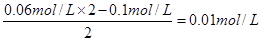 。则根据水的离子积常数可知,溶液中氢离子的浓度是1×10-12mol/L,所以pH=12,答案选C。
。则根据水的离子积常数可知,溶液中氢离子的浓度是1×10-12mol/L,所以pH=12,答案选C。
点评:该题是高考中的常见考点,属于中等难度的试题。该题的关键是首先判断酸碱的过量问题,特别需要注意的是,如果碱过量,则首先要计算溶液中OH-的浓度,然后再换算成氢离子的浓度,否则会得出错误的结论。
本题难度:一般