微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温时,将V1 mL C1 mol·L-1的氨水滴加到V2mL C2 mol·L-1的盐酸中,下述结论中正确的是(? )
A.若混合溶液的pH=7,则C1V1> C2V2
B.若V1=V2, C1=C2,则混合液中c(NH4+)=c(Cl_)
C.若混合溶液的pH="7," 则混合液中c(NH4+)=c(Cl_)
D.若V1=V2,且混合液的pH<7,则一定有C1<C2
参考答案:AC
本题解析:由于氨水是弱碱,二者恰好反应时,溶液显酸性。如果溶液显中性,说明氨水一定是过量的,A正确,B、D不正确。根据电荷守恒可知c(NH4+)+c(H+)=c(Cl_)+c(OH-),所以选项C正确。答案选AC。
本题难度:一般
2、选择题 下列说法或表示正确的是
[? ]
A.等质量的白磷蒸气和白磷固体分别完全燃烧,后者放出热量多
B.C(石墨)→C(金刚石);ΔH=+1.19 kJ· mol-1,所以金刚石比石墨稳定
C.在101kPa,1mol物质完全燃烧生成稳定氧化物时所放出的热量叫该物质的燃烧热
D.在101 kPa下,2g H2完全燃烧生成液态水放出285.8 kJ热量,其热化学方程式为
2H2(g)+O2(g)= 2H2O(l);ΔH=-285.8 kJ· mol-1
参考答案:C
本题解析:
本题难度:一般
3、选择题 常温常压下pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=11,则强碱与强酸的体积比是(?)
A.11∶1
B.9∶1
C.1∶11
D.1∶9
参考答案:D
本题解析:常温常压下水,Kw=10-14,溶液的pH=11,所以c(OH-)=10-3 mol·L-1,pH=13的强碱溶液的c(OH-)=10-1 mol·L-1,pH=2的强酸溶液的c(H+)= 10-2 mol·L-1,设强碱的体积为a,强酸的体积为b,即(10-1×a-10-2×b)/(a+b)==10-3,化简得到a=9b,所以强碱与强酸的体积比是1∶9,故本题的答案为D。
点评:本题考查了pH的计算,该考点为高考常考的考点,本题难度适中。
本题难度:简单
4、填空题 纯水在20 ℃的pH?(填“大于”或“小于”)80 ℃时的pH。
参考答案:大于
本题解析:水的电离为吸热反应,H2O H++OH-,升温平衡右移,氢离子浓度增大,pH减小,故纯水在20 ℃的pH大于80 ℃时的pH
H++OH-,升温平衡右移,氢离子浓度增大,pH减小,故纯水在20 ℃的pH大于80 ℃时的pH
本题难度:简单
5、计算题 (8分)某温度(t℃)时,水的KW=10-13,则该温度(填大于、等于或小于)
(1)_____25℃,理由是_________________________________________________,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
(2)若所得混合溶液为中性,则a:b=_________;
(3)若所得混合溶液pH=2,则a:b=__________。
参考答案:(1)大于;水的电离吸热,升高温度,促进水的电离,KW增大
(2)10:1?(3)2:9
本题解析:(1)25℃时水的离子积常数是10-14,如果水的KW=10-13,则温度一定大于25℃.因为电离是吸热的,所以加热促进水的电离,离子积常数增大。
(2)此温度下pH=11的NaOH溶液的浓度是0.01mol/L。所得混合溶液为中性,说明氢离子的物质的量和OH-物质的量相等,即a×10-2=b×10-1,解得a︰b=10︰1。
(3)所得混合溶液pH=2,说明硫酸是过量的,因此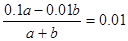 ,解得a︰b=2︰9。
,解得a︰b=2︰9。
本题难度:一般