微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 21.(10分)某中药主要含二硫化亚铁(FeS2),某学习小组欲用下图所示装置进行实验,测定其铁、硫元素的质量分数。
(1)装置中,A为高温灼烧装置,B为气体吸收装置,C为检测尾气中是否含有SO2的传感器。取m g该中药样品于装置A中,经充分反应,使硫元素全部转化为SO2和SO3,在B中得到白色沉淀,传感器(装置C)未检测到SO2。
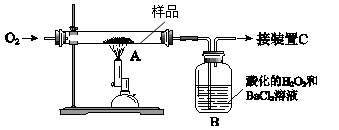
① 装置B中的H2O2反应时表现出了 性。
② 欲计算硫元素的质量分数,需测量的数据是 。
③ 传感器的工作原理如下图所示。

传感器中阴极的电极反应式是 。
(2)为测定铁元素的质量分数,继续实验。
a.将A装置中的剩余固体用足量盐酸酸浸,有少量H2产生。充分反应后过滤,得到黄色滤液;
b.向滤液中滴加TiCl3溶液,至恰好完全反应,TiCl3被氧化为TiO2+;
c.用滴定法测定Fe2+的量,消耗v mL n mol/LK2Cr2O7溶液。
① a中滤液含有的金属阳离子是 。
② b中反应的离子方程式是 。
③ c中K2Cr2O7被还原为Cr3+,样品中铁元素质量分数的数学表示式是 。
2、填空题 海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋 资源。试回答下列问题:
资源。试回答下列问题:
(1)海水中含有大量的氯化钠。氯化钠中的金属元素化合价为?;除去NaCl溶液中的SO42-,可依次加入?、 ?和?三种溶液。
?和?三种溶液。
(2)目前国际上使用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是 将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是?(填“物理变化”、
将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是?(填“物理变化”、 “化学变化”),蒸馏法所用的主要玻璃仪器有________________________(写三种)。
“化学变化”),蒸馏法所用的主要玻璃仪器有________________________(写三种)。
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式为:
食盐+H2O NaOH+H2+Cl2(未配平)。利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐?t 。
NaOH+H2+Cl2(未配平)。利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐?t 。
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法流程如下:
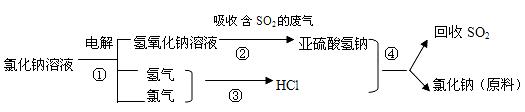
写出反应②③的化学反应方程式:?,?。
3、选择题 能使反应Cu + 2H+ = Cu2++H2↑发生的是?(?)
A.用铜片作阴、阳极,电解CuCl2溶液
B.铁片作正极,Cu片作负极,CuCl2作电解质溶液的原电池
C.用铜片作阴、阳极,电解H2SO4溶液
D.铜锌合金在潮湿的酸性空气中发生电化学腐蚀
4、选择题 下列叙述中错误的是( )
A.电解池的阳极上发生氧化反应,阴极上发生还原反应
B.原电池跟电解池连接后,电子从电池负极流向电解池阳极
C.电镀时,电镀池里的阳极材料发生氧化反应
D.电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气
5、填空题 甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。已知:
CH3OH(1) + O2(g) = CO(g) + 2H2O(g) ;△Ha = -443.64 kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) ;△H b =-566.0 kJ·mol-1
(1)试写出CH3OH(1)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式:______________________
(2)甲醇作为燃料,它的优点是燃烧时排放的污染物少,从而不仅能缓解能源紧张和温室效应的问题,还能改善大气质量。试利用(1)中的热化学方程式计算,完全燃烧20g甲醇,生成二氧化碳和水蒸汽时,放出的热量为__________kJ,生成的CO2气体标准状况下体积是___________L
(3)科研人员新近开发出一种由甲醇和氧气以强碱做电解质溶液的新型手机电池,可使手机连续使用一个月才充一次电,据此回答下列问题:
甲醇在____________极反应;电极反应式为__________________________。
(4)利用电池可实现电能向化学能转化。某同学设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是___________(填序号)
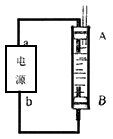
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-→H2↑
若将所得Fe(OH)2沉淀暴露在空气中,其颜色变化是__________________________,反应的化学方程式为
_________________________。