微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 分析下列反应:5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O,据此作答:
(1)标出该反应中电子的转移方向和数目:5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O
(2)该反应的氧化剂是______.
(3)该反应的氧化产物与还原产物的质量比是______.
(4)当反应生成0.3mol?Cl2时,则转移的电子的物质的量是______.
参考答案:(1)该反应中氯化钾中氯元素化合价由-1价变为0价,氯酸钾中氯元素的化合价由+5价变为0价,所以其转移电子数是5,
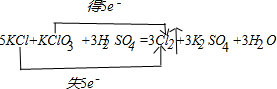
,
故答案为:
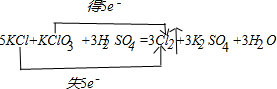
;
(2)该反应中,氯酸钾中氯元素的化合价由+5价变为0价,所以氯酸钾是氧化剂,故答案为:KClO3;
?(3)该反应中还原剂是氯化钾,氧化剂是氯酸钾,则氧化产物是氯气,还原产物也是氯气,氧化产物和还原产物的质量之比是5:1,故答案为:5:1;
(4)当反应生成0.3mol?Cl2时,则转移的电子的物质的量=0.3mol×5=0.5?mol,
故答案为:0.5mol.
本题解析:
本题难度:一般
2、选择题 下列物质中,Fe元素不能被氧化的是( )
A.Fe
B.FeO
C.Fe2O3
D.FeSO4
参考答案:A.铁的化合价是0价,处于最低价态,所以有还原性,能被氧化,故A错误;
B.氧化亚铁中铁元素处于中间价态,既有氧化性又有还原性,所以能被氧化,故B错误;
C.氧化铁中铁元素处于最高价态,只有氧化性,所以不能被氧化,故C正确;
D.硫酸亚铁中铁元素处于中间价态,既有氧化性又有还原性,所以能被氧化,故D错误;
故选C.
本题解析:
本题难度:简单
3、填空题 在MnO2+4HCl=MnC12+C12↑+2H2O的反应中:
①______是氧化剂
②发生氧化反应的物质是______.
③在参加反应的盐酸中.起还原剂作用的HC1与起酸性作用的HC1的质量比为______.
④当1mol的MnO2完全反应时电子转移的总数为______mol.
参考答案:①在MnO2+4HCl=MnC12+C12↑+2H2O的反应中,MnO2中Mn元素化合价降低,在反应中MnO2为氧化剂,故答案为:MnO2;
②HCl中Cl元素化合价升高为0价,被氧化,故答案为:HCl;
③由方程式可以看出,4molHCl参加反应,有2mol被氧化,另2molHCl生成MnC12,表现出酸性,起还原剂作用的HC1与起酸性作用的HC1的质量比为1:1,故答案为:1:1;
④当1mol的MnO2完全反应时,得到的电子的物质的量为1mol×(4-2)=2mol,故答案为:2.
本题解析:
本题难度:一般
4、选择题 下列变化需要加入还原剂才能实现的是( )
A.Na2SO3→SO2
B.HCl→Cl2
C.H2SO4(浓)→SO2
D.S→SO2
参考答案:C
本题解析:
本题难度:一般
5、选择题 有关氧化还原反应实质的说法中正确的是( )
A.是否有元素化合价的变化
B.是否有氧元素的参加
C.是否有电子的转移
D.是否有新物质生成
参考答案:氧化还原反应中,氧化剂在反应中得电子,被还原,具有氧化性,所含元素化合价降低,还原剂在反应中被氧化,失电子,所含元素化合价升高,实质是有电子的转移.
故选C.
本题解析:
本题难度:简单