微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题
A、B、C、D为原子序数依次增大的四种短周期元素,其性质或结构信息如下表:

试回答以下问题
(1)B在周期表中的位置是?。B的氢化物与E的氢化物比较,沸点较高的是?(填化学式),在水中溶解度较大的是?(填化学式)
(2)写出D3B与甲反应所得溶液呈?(填“酸性”、“碱性”或“中性”),原因是(用化学方程式表示)?。
(3)写出丙的电子式为?。说明丙的水溶液在放置过程中其酸性会增强的原因(用离子方程式表示)?。
(4)由A、B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈碱性。可用来鉴别丁和氯化钠的试剂有?
A.氢碘酸和淀粉的混合液? B.AgNO3溶液
C.甲基橙试剂? D.稀硫酸
(5)将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成深绿色溶液,写出该反应的离子方程式?。
参考答案:(1)第二周期ⅤA族,NH3,NH3?
(2)碱性,Na3N+3H2O= NH3↑+3NaOH
(3)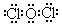 ,2HClO
,2HClO  2H++2Cl-+ O2↑
2H++2Cl-+ O2↑
(4)AD(2分)?
(5)Cu +2NO2- +4H+ = Cu2+ +2NO↑+2H2O
本题解析:由题意知,钠在空气中燃烧生成淡黄色固体过氧化钠,D为Na;D3B中阴阳离子电子层结构相同可推出D、B分别为Na、N;则A为H、C为O;丙的相对分子质量为87,若丙中含有1个O,则丙为Cl2O;若丙中含有2个O,不合题意;若丙中含有3个O,丙为KO3,但KO3不是气态,所以E为Cl。
(1)N位于第二周期VA族。NH3存在分子间氢键,HCl分子间不存在氢键,NH3的沸点高于HCl;NH3和HCl都是极性分子,都能溶于水,但NH3与水能形成分子间氢键,NH3在水中溶解度大于HCl。
(2)Na3N与H2O生成NaOH与NH3,溶液呈碱性。
(3)Cl2O结构式为Cl-O-Cl,电子式为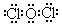 。Cl2O与水生成HClO,HClO光照条件下生成盐酸和氧气,溶液酸性增强。
。Cl2O与水生成HClO,HClO光照条件下生成盐酸和氧气,溶液酸性增强。
(4)丁为NaNO2。NaNO2能与氢碘酸生成I2,淀粉遇碘变蓝,A正确;亚硝酸钠与氯化钠与硝酸银溶液均生成白色沉淀,B错误;甲基橙变色范围是3.1~4.4,氯化钠溶液与亚硝酸钠溶液遇甲基橙溶液均呈黄色,C错误;亚硝酸钠与稀硫酸生成亚硝酸,亚硝酸分解生成红棕色气体二氧化氮,D正确。
(5)酸性条件下,NO2-具有氧化性,能将Cu氧化生成Cu2+,NO2-本身被还原为NO。
本题难度:一般
2、选择题 下列说法正确的是(?)
A.所有的原子核内质子数都比中子数多
B.氢离子(H+)实质上是一个裸露的质子
C.核外电子排布相同的粒子,其化学性质也相同
D.非金属元素原子的最外层电子数都大于4
参考答案:B
本题解析:并非所有的原子核内质子数都比中子数多,A选项错误;氢离子(H+)就是氢原子失去外层的一个电子,只剩下一个原子核,带一个单位的正电荷,实质上是一个裸露的质子,B正确;核外电子排布相同的粒子,如:Na+、Mg2+、Al3+、Ne、O2-、F-等,性质各不相同,C错误;并不是非金属元素原子最外层电子数都大于4,如氢、硼等。
本题难度:简单
3、填空题 (8分)由以下一些微粒:136C、3919K、4020Ca、126C、147N、4018Ar。其中:
小题1:互为同位素的是________和________;
小题2:质量数相等,但不能互称同位素的是_________和__________;
小题3:中子数相等,但质子数不相等的是_________和_________; _________和_________。
参考答案:
小题1:136C?126C;
小题2: 4020Ca?4018Ar;
小题3: 3919K?4020Ca ;136C?147N
本题解析:考查同位素的概念和原子的组成以及表示方法等。同位素是指质子数相同而中子数不同的同一种元素的不同核素。在表示原子组成时,在元素符号的左下角表示质子数,左上角表示的质量数。质子数和中子数的之和是质量数,所以6种微粒的中子数分别为7、20、20、6、7、22。
本题难度:简单
4、选择题 下列说法不正确的是
A.进行分液操作时,应先打开上口活塞或使塞上的凹梢对准漏斗口的小孔,然后打开旋塞,下层液体从下口放出,上层液体从漏斗上口倒出
B.纸层析法是以滤纸为惰性支持物,水为固定相,有机溶剂作流动相.用该方法可分离Fe3+和Cu2+,层析后氨熏显色,滤纸上方出现红棕色斑点
C.酸式滴定管,碱式滴定管、容*瓶、移液管都是准确量取一定体积液体的景器,它?们在使用时都要进行检查是否漏水、水洗、润洗、注液、调整液面等几个过程
D.金属钾、钠和白磷等暴露在空气中易燃烧,所以金属钾、钠应保存在煤油中,白磷?则可保存在水中.取用它们时要用镊子
参考答案:C
本题解析:分析:A、依据分液漏斗的使用方法分析判断;
B、纸层析法是利用离子在滤纸上的移动速度不同,进行分离,铁离子在上层,遇到氨水生成红褐色沉淀氢氧化铁;
C、容量瓶是配制准确浓度溶液的容器,不需要水洗润洗注液;
D、钠和钾密度大于煤油,保存在煤油中,白磷溶于煤油中,着火点低,不和水反应保存在水中隔离空气,取用固体用镊子;
解答:A、进行分液操作时,应先打开上口活塞或使塞上的凹梢对准漏斗口的小孔,然后打开旋塞,下层液体从下口放出,上层液体从漏斗上口倒出符合实验基本操作故A正确;
B、纸层析法是以滤纸为惰性支持物,水为固定相,有机溶剂作流动相.用该方法可分离Fe3+和Cu2+,纸层析法是利用离子在滤纸上的移动速度不同,进行分离,铁离子在上层,遇到氨水生成红褐色沉淀氢氧化铁层析后氨熏显色,滤纸上方出现红棕色斑点,故B正确;
C、酸式滴定管,碱式滴定管、移液管都是准确量取一定体积液体的容器,它们在使用时都要进行检查是否漏水、水洗、润洗、注液、调整液面等几个过程,容量瓶不需要水洗润洗、注液操作,故C错误;
D、钠和钾密度大于煤油,保存在煤油中,白磷溶于煤油中,着火点低,不和水反应保存在水中隔离空气,取用固体用镊子,故D正确;
故选C.
点评:本题考查了实验基本操作的熟练掌握,注意仪器的使用方法和注意问题是解题关键,题目难度中等.
本题难度:简单
5、填空题 (14分)A、B、C、D、E、F均为前四周期的元素,原子序数依次增大,A的核外电子数等于其电子层数,B的最外层电子数是次外层电子数的3倍,A和C、B和E同主族,B、C、D的离子具有相同的电子层结构,D的离子是同周期中离子半径最小的,F原子中共有6个未成对电子。
请回答下列问题:
⑴写出下列元素的元素符号:A ?▲?、C? ▲?、E? ▲?、F? ▲?。
⑵元素A和元素B可以形成A2B物质甲,写出甲的分子式? ▲?,甲为? ▲?(填“极性”或“非极性”)分子。
⑶元素A和元素E形成化合物乙,用电子式表示化合物乙? ▲?;常温下甲为液态,乙为气态,试解释原因? ▲?。
⑷元素A与元素C形成化合物丙,丙的水溶液显碱性,试用化学方程式解释其原因:
? ▲?。
⑸元素C、元素D的最高价氧化物的水化物相互反应的离子方程式是? ▲?。
⑹写出元素F的外围电子排布式? ▲?。
参考答案:(14分)
(1)H Na? S? Cr?(每空1分,共4分)
(2)H2O (1分) 极性(1分)
(3) (1分) 甲分子间存在氢键,乙分子间无氢键(1分)
(1分) 甲分子间存在氢键,乙分子间无氢键(1分)
(4)NaH+H2O=NaOH+H2↑(2分)
(5)Al(OH)3+OH-=AlO2-+2H2O(2分)
(6)3d54s1?(2分)
本题解析:略
本题难度:简单