微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向的硫酸中加入100mL18mol/L足量铜片,加热并充分反应。下列有关说法正确的是
A.充分反应后转移1.8mol电子
B.H2SO4只作氧化剂
C.若不加热应生成H2
D.消耗的铜的质量一定少于57.6g
参考答案:D
本题解析:试题分析:18mol/L的硫酸为浓硫酸,铜与浓硫酸反应的化学方程式:
Cu+2H2SO4 CuSO4+SO2
CuSO4+SO2 +2H2O;根据化学方程式,可得等式
+2H2O;根据化学方程式,可得等式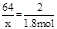
所以消耗的铜的质量为57.6g,但由于随着反应的进行,硫酸的浓度减小,铜不与稀硫酸反应,因此,消耗的铜的质量一定少于57.6g。故答案选D。
考点:铜与硫酸的反应
点评:本题是对铜与浓硫酸反应的考查,需注意的是随着反应的进行,硫酸浓度降低,反应即停止;另一个需要加以区分的是与硝酸的反应,由于硝酸具有氧化性,因此铜与浓硝酸、稀硝酸均发生反应,只是反应产物不一样而已。
本题难度:困难
2、选择题 将一定体积的CO2通入VL NaOH溶液中,已知NaOH完全反应,若在反应后的溶液中加入足量石灰水,得到ag沉淀;若在反应后的溶液中加入足量CaCl2溶液,得到bg沉淀,则下列说法正确的是
A.b可能等于a、小于a或大于a
B.若a=b,则CO2与NaOH溶液反应的盐只有Na2CO3
C.用上述数据不能确定NaOH溶液的物质的量浓度
D.参加反应的CO2体积为0.224aL
参考答案:B
本题解析:加入足量石灰水,使溶液中的 、
、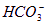 全部生成CaCO3沉淀,而加入足量CaCl2溶液,只能使溶液中的
全部生成CaCO3沉淀,而加入足量CaCl2溶液,只能使溶液中的 生成CaCO3沉淀,所以A≥B,当A=B时,说明溶液中无
生成CaCO3沉淀,所以A≥B,当A=B时,说明溶液中无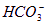 ;标准状况下,参加反应的CO2的物质的量为
;标准状况下,参加反应的CO2的物质的量为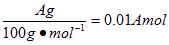 ,即体积为0.224A L;用上述数据可知溶液中Na2CO3的物质的量=
,即体积为0.224A L;用上述数据可知溶液中Na2CO3的物质的量=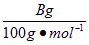 =0.01B mol,NaHCO3的物质的量=0.01A mol-0.01B mol,依据钠守恒即可确定NaOH的物质的量。
=0.01B mol,NaHCO3的物质的量=0.01A mol-0.01B mol,依据钠守恒即可确定NaOH的物质的量。
本题难度:简单
3、选择题 下列化合物中,能由两种单质直接化合生成的是
A.Fe3O4
B.C2H4
C.NO2
D.SO3
参考答案:A
本题解析:正确答案:A
A、3Fe+2O2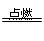 Fe3O4符合题意。B、来源于石油裂解;C、N2+O2
Fe3O4符合题意。B、来源于石油裂解;C、N2+O2 2NO,得不到NO2;?D、S+O2
2NO,得不到NO2;?D、S+O2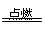 SO2,不生成SO3
SO2,不生成SO3
本题难度:一般
4、选择题 现有FeO和Fe2O3组成的混合物ag,向其中加入2mol/L的硫酸溶液100mL,恰好完全反应;若将ag该混合物与足量的铝热反应,冷却后最终可得铁的质量为
A.3.2ag
B.3.2+a?g
C.(a-3.2)g
D.(a-6.4)g
参考答案:C
本题解析:分析:FeO和Fe2O3组成的混合物与硫酸反应生成硫酸盐和水,氧离子为-2价,硫酸根为-2价,可知FeO和Fe2O3组成的混合物中氧原子的物质的量等于硫酸的物质的量,即n(O)=n(H2SO4),FeO和Fe2O3组成的混合物质量减去氧的质量即为金属铁的质量.
解答:n(H2SO4)=0.01L×2mol/L=0.02mol,
所以FeO和Fe2O3组成的混合物中O的质量为0.02mol×16g/mol=0.32g,
若将ag该混合物与足量的铝热反应,使其充分反应,终可得铁的质量为ag-0.32g=(a-0.32)g.
故选:C.
点评:本题考查混合物的计算,题目难度中等,本题根据氧离子与硫酸根硫酸根的化合价,利用等量代换法,得出硫酸的物质的量与金属氧化物中O元素的物质的量相等,此为解答该题的关键,也可以金属氧化物与硫酸反应的关系式确定.
本题难度:一般
5、选择题 C和CuO在高温下反应可能生成Cu、Cu20、C02、CO.现将1g碳粉跟8gCuO混合,在硬质试管中隔绝空气高温加热,生成的气体全部通过足量NaOH溶液,收集残余气体.测得溶液增重1.1g,残余气体在标准状况下的体积为560mL.下列说法错误的
A.固体混合物高温加热时,有0.6g碳参加了反应
B.试管中的所有氧化还原反应共转移电子0.15mol
C.反应后的试管中固体混合物总质量为7.2g
D.反应生成铜和氧化亚铜的总物质的量为0.1mol
参考答案:D
本题解析:分析:生成的气体全部通过足量NaOH溶液,收集残余气体.测得溶液增重1.1g为二氧化碳的质量,二氧化碳的物质的量为0.025mol,残余气体在标准状况下的体积为560mL为一氧化碳的体积,一氧化碳的物质的量为0.025mol.
A、根据碳元素守恒可知参加反应的碳原子物质的量等于二氧化碳与一氧化碳的物质的量之和,根据m=nM计算参加反应的碳的质量.
B、反应中碳元素化合价升高,铜元素化合价降低,根据碳元素的化合价变化计算转移电子数目.
C、碳粉与CuO的总质量减去二氧化碳及一氧化碳的质量即为反应后的试管中固体混合物总质量.
D、根据氧原子守恒计算反应后试管中固体混合物含有的氧原子物质的量,进而计算氧化亚铜的物质的量,再根据铜元素守恒计算反应生成铜的物质的量.
解答:生成的气体全部通过足量NaOH溶液,收集残余气体.测得溶液增重1.1g为二氧化碳的质量,二氧化碳的物质的量为 =0.025mol,残余气体在标准状况下的体积为560mL为一氧化碳的体积,一氧化碳的物质的量为
=0.025mol,残余气体在标准状况下的体积为560mL为一氧化碳的体积,一氧化碳的物质的量为 =0.025mol.
=0.025mol.
A、根据碳元素守恒可知参加反应的碳原子物质的量等于二氧化碳与一氧化碳的物质的量之和,所以参加反应的碳元素质量为(0.025mol+0.025mol)×12g/mol=0.6g,故A正确;
B、反应中碳元素化合价升高,铜元素化合价降低,所以转移电子物质的量为0.025mol×4+0.025mol×2=0.15mol,故B正确;
C、生成的二氧化碳与一氧化碳的总质量为0.025mol×44g/mol+0.025mol×28g/mol=1.8g,所以反应后试管中固体混合物总质量为(1g+8g)-1.8g=7.2g,故C正确.
D、氧化铜的物质的量为 =0.1mol,二氧化碳与一氧化碳含有的氧原子物质的量为0.025mol×2+0.025mol×1=0.075mol,反应后氧原子存在于氧化亚铜中,所以氧化亚铜的物质的量为0.1mol-0.075mol=0.025mol,铜的物质的量为0.1mol-0.025mol×2=0.05mol,反应生成铜和氧化亚铜的总物质的量为0.075mol,故D错误.
=0.1mol,二氧化碳与一氧化碳含有的氧原子物质的量为0.025mol×2+0.025mol×1=0.075mol,反应后氧原子存在于氧化亚铜中,所以氧化亚铜的物质的量为0.1mol-0.075mol=0.025mol,铜的物质的量为0.1mol-0.025mol×2=0.05mol,反应生成铜和氧化亚铜的总物质的量为0.075mol,故D错误.
故选:D.
点评:考查混合物的计算,难度较大,是对所学知识的综合运用,关键根据原子守恒进行计算,注意守恒思想在混合物计算的运用.
本题难度:困难