微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将2mol C气体在2 L的容器中混合并在一定条件下发生如下反应:2C(气) 2A(气)+B(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2A(气)+B(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1?②用物质B表示的反应的平均速率为0.1 mol·L-1·s-1③2?s时物质C的转化率为40% ④2?s时物质B的浓度为0.2 mol·L-1
其中正确的是( )
A.①③
B.①④
C.②③
D.②③④
参考答案:D
本题解析:考查可逆反应的有关计算。经2 s(秒)后测得C的浓度为0.6 mol·L-1,则消耗C是2mol-0.6mol/L×2L=0.8mol,则
2C(气) 2A(气)+B(气)
2A(气)+B(气)
起始量(mol)? 2? 0? 0
转化量(mol)? 0.8? 0.8? 0.4
平衡量(mol)? 1.2? 0.8? 0.4
所以用物质A表示的反应平均速率为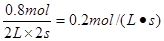
用物质B表示的反应的平均速率为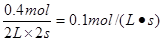
2?s时物质C的转化率为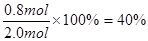
2s时物质B的浓度为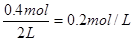
因此正确的答案是D。
本题难度:一般
2、选择题 反应4A(s)+3B(g)=2C(g)+D(g),经2min后B的浓度减少了0.6mol/L。关于此反应速率的说法正确的是
[? ]
A.用A物质表示的反应速率是0. 4mol/(L·min)
B.用C物质表示的反应速率是0. 2mol/(Lmin)
C.在2min末的反应速率,用B物质表示是0.3mol/(L·min)
D.在2min内用B物质和C物质表示的反应速率的值都是逐渐减小的
参考答案:BC
本题解析:
本题难度:一般
3、填空题 在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:
A(g) B(g)+C(g) ΔH=+85.1 kJ·mol-1
B(g)+C(g) ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h
| 0
| 1
| 2
| 4
| 8
| 16
| 20
| 25
| 30
|
总压强p/100 kPa
| 4.91
| 5.58
| 6.32
| 7.31
| 8.54
| 9.50
| 9.52
| 9.53
| 9.53
|
?
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为____________。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为______________。平衡时A的转化率为__________,列式并计算反应的平衡常数K__________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n(总)=____ mol,n(A)=________ mol。
②下表为反应物A浓度与反应时间的数据,计算:a=________。
反应时间t/h
| 0
| 4
| 8
| 16
|
c(A)/(mol·L-1)
| 0.10
| a
| 0.026
| 0.006 5
|
?
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是________________________________,由此规律推出反应在12 h时反应物的浓度c(A)为__________ mol·L-1。
参考答案:(1)升高温度、降低压强
(2)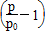 ×100% 94.1%
×100% 94.1%
A(g)  B(g) + C(g)
B(g) + C(g)
0.10 ?0?0
10×(1-94.1%) 0.10×94.1% 0.10×94.1%
K=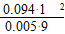 =1.5
=1.5
(3)①0.10× 0.10×
0.10×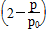 ②0.051 达到平衡前每间隔4 h,c(A)减少约一半 0.013
②0.051 达到平衡前每间隔4 h,c(A)减少约一半 0.013
本题解析:(1)要提高A的转化率,实际就是使平衡正向移动,根据方程式的特点正反应为气体物质的量增大的反应,且为吸热反应,可确定采取的措施。
(2)由阿伏加德罗定律推论可知,在恒温、恒容条件下,压强与物质的量成正比,将压强变化转化为物质的量变化,从而解决压强与转化率的关系。
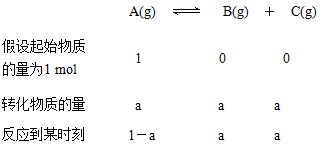
所以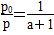 ,解得a=(
,解得a=( -1) mol。
-1) mol。
α(A)=( -1)×100%
-1)×100%
平衡时A的转化率=(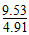 -1)×100%≈94.1%。
-1)×100%≈94.1%。
(3)①与(2)思路相似,应用阿伏加德罗定律推论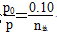 ,得n总=0.10×
,得n总=0.10× 。
。
由方程式特点,应用差量法可知,反应过程增加的气体的物质的量,恰好等于反应的A的物质的量。
即:0.1-n(A)=n(总)-0.1
解得n(A)=0.2-0.1×
②从上表读出4 h时p=7.31
计算得n(A)=0.2-0.1×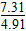 ≈0.051
≈0.051
依据此表中相邻两数据的差,即可得出规律。
本题难度:一般
4、选择题 氙和氟单质按一定比例混合,在一定条件下反应达到如下平衡:Xe(g)+2F2(g)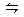 XeF4(g)?△H<0,下列措施中既能加快反应速率,又能使平衡向正反应方向移动的是(?)
XeF4(g)?△H<0,下列措施中既能加快反应速率,又能使平衡向正反应方向移动的是(?)
A.升温
B.加压
C.减压
D.降温
参考答案:B
本题解析:升温和加压可加快反应速率,又由于反应Xe(g)+2F2(g)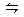 XeF4(g)?△H<0的特点,升温能使平衡向逆反应方向移动,加压能使平衡向正反应方向移动。
XeF4(g)?△H<0的特点,升温能使平衡向逆反应方向移动,加压能使平衡向正反应方向移动。
本题难度:一般
5、填空题 将E和F加入固定容积的密闭容器中,在一定条件下发生反应:
E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
压强/MPa
体积分数/%
温度/℃
| 1.0
| 2.0
| 3.0
|
810
| 54.0
| a
| b
|
915
| c
| 75.0
| d
|
1000
| e
| f
| 83.0
|
(1)915℃、2.0MPa时E的转化率为?。
(2)该反应的△S?0(填“>”、“<”或“=”,下同),b?f。
(3)平衡常数K(1000℃)??K(810℃) ,理由是?。
(4)对于上述反应,下列说法正确的是?(填序号)。
①混合气体的密度不再变化,反应达到平衡
②该反应的正反应为放热反应
③增大F的量,单位体积活化分子数增大,化学反应速率加快
④恒温恒容条件下通入惰性气体,平衡不移动
⑤恒温恒压条件下通入惰性气体,化学反应速率加快
参考答案:(1)60%(2分)
(2)>(1分);<(1分)?
(3)>(1分);
该反应的正反应为吸热反应,升高温度平衡正向移动,平衡常数增大(1分)
(4)①④(2分,漏选得1分,错选不得分);
本题解析:(1)假设一开始加入的E的物质的量为amol
E(g)? +? F(s)? ?2G(g)
?2G(g)
起始: amol? 0mol
变化: bmol?2bmol
平衡:(a-b)mol? 2bmol
依题意有: ?
?
915℃、2.0MPa时E的转化率为:60%
(2)该反应中由1mol的E生成2mol 的F,也就是说是一个熵增的方向,因此△S >0(1分);第二个空中使用控制变量法,先比较a和b的大小,对于这个反应来讲,温度一定条件下,压强越大,转化率越小,因此有: b <a<54℅,那么从表中可以看出,在二个大气压下,从上到下,随温度的升高,数值应该是越来越大,因此有b <a<54℅<75℅<f 。(3)从上到下温度越来越高,G的含量越来越大,意味着温度升高,平衡正向移动,表明正向是一个吸热的方向,因此平衡常数K(1000℃)> K(810℃);
(4)①混合气体的密度不再变化,那么反应物F的量不再变化,意味着各反应物和生成物的浓度都不再变化成了一定值,反应达到平衡,正确;②该反应的正反应为吸热反应,错误;③增大F的量,F是固体,浓度是定值,不会使得单位体积活化分子数增大,化学反应速率不变,错误;④恒温恒容条件下通入惰性气体,不改变各物质的浓度,平衡不移动,正确;⑤恒温恒压条件下通入惰性气体,各组分的浓度不变,化学反应速率不变,错误。
本题难度:一般