微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 .A、B、C均为短周期元素,它们在周期表中的位置如图所示.已知B、C两元素原子序数之和为A元素原子序数的4倍,则A、B、C依次是(?)
A.C、Al、P? B.N、Si、S? C.O、P、Cl? D.F、S、Ar
参考答案:C
本题解析:设A的原子序数为a,由题意可求出a为8
本题难度:一般
2、选择题 元素R的最高价含氧酸的化学式为HnRO2n-2?,则在气态氢化物中R元素的化合价为(?)
A.12-3n
B.3n-12
C.3n-10
D.6-3n
参考答案:B
本题解析:气态氢化物中元素一般为最低价态,根据化合物中化合价的代数和为0,R元素的最高价含氧酸中R的化合价为: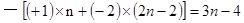 ,最低价的绝对值与最高价态的和为8,所以R的最低价态(为负值)为
,最低价的绝对值与最高价态的和为8,所以R的最低价态(为负值)为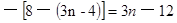 ,答案选B。
,答案选B。
本题难度:简单
3、填空题 A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。A元素的一种核素质子数与质量数在数值上相等;B、E同主族,且核电荷数之比为1︰2;C的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子;D的最外层电子数是内层电子总数的一半。试回答下列问题:
(1)F位于周期表中第________周期________族。
(2)常温时,39 g B、C按原子个数比1︰l形成的化合物X与足量CO2反应放出Q kJ的热量,写出该反应的热化学方程式?;
写出少量X与FeCl2溶液反应的离子方程式_______________________________________。
(3)B、C、F组成的化合物Y是家用消毒剂的主要成分,Y的溶液呈碱性,用离子方程式解释其原因______________________________;起消毒作用的微粒电子式为_________。
(4)四原子分子Z与C的单质和水反应所得的阴离子电子数相等,Z的分子空间构型为___________型,它属于_________分子(填“极性”或“非极性”);请比较Z与DA3的沸点高低并加以解释_____________________________________________________。
(5)目前人们正在研究开发一种高能电池,它是以熔融的C、E单质为两极,以C离
子导电的β-Al2O3陶瓷作固体电解质,反应式为:2C+xE  ?C2Ex。请写出电池放电时正负极的电极反应式,正极反应式:_______________________。用该电池作电源进行电解含有0.2 mol CuSO4和0.2 mol NaCl的混合溶液500 mL时:若此电池工作一段时间后消耗23 g C单质。则阳极产生气体体积为:________L(标准状况下);电解后溶液加水稀释至2 L ,溶液的pH为:________。
?C2Ex。请写出电池放电时正负极的电极反应式,正极反应式:_______________________。用该电池作电源进行电解含有0.2 mol CuSO4和0.2 mol NaCl的混合溶液500 mL时:若此电池工作一段时间后消耗23 g C单质。则阳极产生气体体积为:________L(标准状况下);电解后溶液加水稀释至2 L ,溶液的pH为:________。
参考答案:(1)三?ⅦA (各1分)?
(2)2Na2O2(s) + 2CO2(g) = 2Na2CO3(s) + O2(g);ΔH= -4Q kJ/mol
3Na2O2 + 6Fe2+ + 6H2O = 6Na+ + 4Fe(OH)3↓+ 2Fe3+(各2分)
(3)ClO-+ H2O  HClO + OH-
HClO + OH- ?(各2分)
?(各2分)
(4)三角锥(1分)极性(1分)NH3的沸点高于PH3,因为NH3分子间存在氢键(2分)
(5)xS+2e-=Sx2-?6.72 L?1(各2分)
本题解析:A元素的一种核素质子数与质量数在数值上相等,说明A是H;B、E同主族,且核电荷数之比为1︰2,B是O,E是S;C的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,C是Na,Na+和OH―电子数相同;D的最外层电子数是内层电子总数的一半,D是P。即A―H、B―O、C―Na、D―P、E―S、F―Cl。
(1)三?ⅦA?
(2)39 gNa2O2反应放出QkJ的能量,2molNa2O2与CO2反应放出4QkJ的能量,所以:
2Na2O2(s) + 2CO2(g) = 2Na2CO3(s) + O2(g);ΔH= -4Q kJ/mol
3Na2O2 + 6Fe2+ + 6H2O = 6Na+ + 4Fe(OH)3↓+ 2Fe3+
(3)ClO-+ H2O  HClO + OH-?
HClO + OH-? ?
?
(4)三角锥(1分)极性(1分)NH3的沸点高于PH3,因为NH3分子间存在氢键(2分)
(5)xS+2e-=Sx2-? ;先后发生下列2个反应:
CuCl2 Cu+Cl2↑,? 2e―?
Cu+Cl2↑,? 2e―?
0.1mol? 0.1mol? 0.2mol?
2CuSO4+2H2O 2 Cu?+O2↑+ H2SO4 ?4e―
2 Cu?+O2↑+ H2SO4 ?4e―
0.1mol? 0.05mol? 0.1mol? 0.2mol
2H2O 2H2↑+O2↑? 4e―
2H2↑+O2↑? 4e―
0.15mol? 0.6mol
阳极共产生0.1mol+ 0.05mol+ 0.05mol="0.3mol," 即6.72 L气体;共产生0.1molH2SO4, 加水稀释至2 L,氢离子的浓度为:0.1mol×2/2L=0.1mol/L,PH= 1 。
本题难度:一般
4、填空题 非金属元素R,其单质4.8g在氧气中充分燃烧生成RO29.6g,在R原子中,核内质子数等于中子数,则R的元素名称为?,其最高价为?,与左右相邻元素比较,R的氢化物比?稳定,R的最高价氧化物的水化物酸性比?弱。
参考答案:硫,+6,PH3,HClO4
本题解析:根据化学反应中质量守恒定律,O2的质量为9.6g-4.8g=4.8g,即在RO2中R与O2的质量相等,故R的摩尔质量与O2的摩尔质量相等,R为S元素,最高价为+6价,非金属性:Cl>S>P,故R的氢化物比PH3稳定,R的最高价氧化物的水化物酸性比HClO4弱。
点评:本题考查的是化学方程式的计算和元素周期律的知识,题目难度不大,考查学生对基础知识的掌握程度及计算能力。
本题难度:一般
5、选择题 下列各物质或微粒性质的比较中正确的是
A.沸点:H2O>H2S>H2Se
B.热稳定性:H2CO3>NaHCO3>Na2CO3
C.半径:Cl<Cl-<S2-
D.酸性:H2CO3<HNO3<H3PO4
参考答案:C
本题解析:略
本题难度:简单