微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 【三选一—选修化学与技术】
晶体硅可用作制芯片和太阳能电池等。下列流程图是工业上制取纯硅的一种方法。

请回答下列问题(各元素用相应的元素符号表示)。
(1)在上述生产过程中,属于置换反应的有__(填反应的代号“I~Ⅳ”)。
(2)A、B、C三种气体在上述生产过程中可循环利用的是___;在“节能减排”中作为减排目标的一种气体是___。
(3)化合物甲的用途很广,有些已应用于高、精、尖科技领域。通常可作建筑工业和造纸工业上的黏合剂。将石英砂和纯碱按一定比例混合加热至1373~1 623 K反应生成化合物甲,其化学方程式为___。
(4)利用反应Ⅲ能制得纯硅的原因是___。
(5)已知反应Ⅳ中产物的总能量比反应物的总能量低,则在密闭容器内反应Ⅳ达到平衡,改变下列 条件,气体B的物质的量增大的是___。
a.缩小容器的容积
b.降低反应体系的温度
c.加入少量NaOH固体(生成物在此温度下不分解)
d.加入少量催化性能更好的催化剂
(6)金属镍(Ni)与气体A能形成常温下为液态的Ni(A)4、利用Ni(A)4的生成与分解可以制得纯度很高的纳米镍,写出Ni( A)4在423K时分解的化学方程式___。
参考答案:(1)I、Ⅱ、Ⅲ
(2)CO、HCl;CO2
(3)SiO2+Na2CO3 Na2SiO3+CO2↑
Na2SiO3+CO2↑
(4)反应体系中只有Si是固体,其他物质在1357?K下均为气体且在Si 中不溶解
(5)b
(6)Ni(CO)4 Ni+4CO↑
Ni+4CO↑
本题解析:
本题难度:一般
2、实验题 医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有 少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分 数为97.0%~103.0%)的主要流程如下:

(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0一8.5,以除去溶液中的少量 Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是_____________________________________________。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量 Ca( OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③____。
(3)测定样品中Cl-含量的方法是:a称取0.7500 g样品,溶解在250 mL容量瓶中定容;b量取25.00 mL待测溶液于锥形瓶中;c用0.05000 moI/LAgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20. 39 mL。
①述测定过程中需用溶液润洗的仪器有_______________ 。
②计算上述样品中CaCl2·2H2O的质量分数为___________________。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有___________________________;_____________________ 。
参考答案:(1)取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe( OH)3沉淀完全
(2)防止溶液吸收空气中的CO2
(3)①酸式滴定管 ;②99.9% ;③样品中存在少量的NaCl ;少量CaCl2·2H2O失水
本题解析:
本题难度:一般
3、填空题 燃料乙醇的生产过程可由下图表示

(1)粉碎玉米的目的是___________。
(2)生产过程中为了检验淀粉水解是否完全,可使用的试剂的是_______________。
(3)步骤a的操作是__________。
A.蒸发?B.萃取?C.蒸馏?D.分液
(4)发酵产生的CO2纯度可达到99%,能回收利用,请举出它的两项用途_____________。
(5)以玉米等淀粉原料生产乙醇的化学反应可用下式表示:
(C6H10O5)n+nH2O→nC6H12O6 C6H12O6→2C2H5OH+2CO2
根据上述反应式,可以算出100?kg淀粉理论上可生产无水乙醇________kg。
参考答案:(1)加快反应速率?
(2)碘水?
(3)C?
(4)制饮料、制干冰、制取纯碱等(任填两种答案合理即可)?
(5)56.8
本题解析:
本题难度:一般
4、填空题 燃料乙醇的生产过程可表示如下

(1)粉碎玉米的目的是________________。
(2)生产过程中为了检验淀粉水解是否完全,可选用的试剂是_______。
(3)步骤a的操作是____
A.蒸发 B.萃取 C.蒸馏 D.分液
(4)发酵产生的CO2纯度可达到99%,能回收利用,请举出它的两项用途___________________。
(5)以玉米等淀粉原料生产乙醇的化学方程式:
①____________________________, ②_____________________________。
根据上述化学方程式计算100 kg淀粉理论上可生产无水乙醇____kg。
参考答案:(1)增大反应物的接触面积,从而加快反应速率
(2)碘水
(3)C
(4)制饮料、制干冰、制烧碱、制碳酸盐(任选两项)
(5)①(C6H10O5)n+nH2O nC6H12O6;②C6H12O6
nC6H12O6;②C6H12O6 2C2H5OH+2CO2↑;56. 8
2C2H5OH+2CO2↑;56. 8
本题解析:
本题难度:一般
5、填空题 草酸亚铁用作分析试剂及显影剂等,其制备流程如下
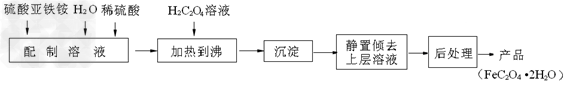
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加少量稀硫酸,目的是______________?。
(2)将制得的产品在氩气气氛中进行热重分析,结果如图(TG%表示残留固体质量占原样品总质量的百分数)。
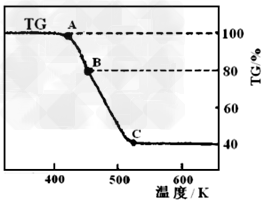
① A→B发生反应的化学方程式为_______________。 C处时残留物的化学式为__________。
②有研究学者在实验过程中用气相色谱还检出H2,最终产物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实:______________?。
③?现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO。加热至1100℃,其中FeO(s)+CO(g)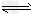 Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?________________
Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?________________
参考答案:(1)抑制Fe2+水解?
(2)①FeC2O4·2H2O(s) FeC2O4(s)+2H2O(g);FeO;②3FeO+H2O
FeC2O4(s)+2H2O(g);FeO;②3FeO+H2O Fe3O4+H2;③71.4%
Fe3O4+H2;③71.4%
本题解析:
本题难度:一般