微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CuO等,生产工艺流程示意如下:
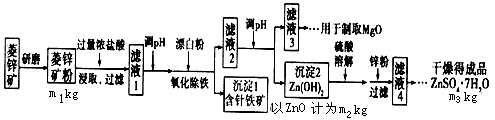
(1)将菱锌矿研磨成粉的目的是 ________________________ 。
(2)完成“氧化除铁”步骤中反应的离子方程式:
口Fe(OH)2+口________+口______=口Fe(OH)3+口Cl-
(3)针铁矿(Coethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O 和H,化学式量为89,化学式是________。
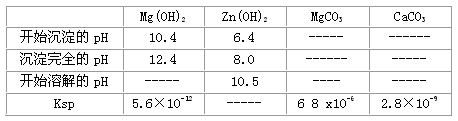
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为___________。
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是____(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为____、____、过滤、洗涤、干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于_______。
2、填空题 某地有软锰矿和闪锌矿两座矿山,它们的组成如下:
软锰矿:MnO2含量≥65%,SiO2含量约20%,Al2O3含量约4%,其余为水分;
闪锌矿:ZnS含量≥80%,FeS、CuS、SiO2含量约7%,其余为水分。
科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。

请回答下列问题:
(1)反应I的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等。试完成反应I中生成CuSO4
和MnSO4的化学方程式:MnO2+CuS+____=_____↓+_______+CuSO4+________
(2)反应Ⅱ加入适量锌的作用是___________;如果锌过量,还会进一步发生反应的离子方程式为______________________。
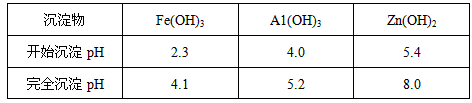
(3)反应III要调节pH生成Fe(OH)3、Al(OH)3,中和过量的H+所使用的物质是___________,调节的pH范围是___________(pH数据见下表)。
(4)本工艺可以循环利用的物质除有MnCO3、ZnCO3以外,还有___________。
3、填空题 复印机使用的墨粉主要成分是Fe3O4,下图是氧化沉淀法生产Fe3O4的工艺:
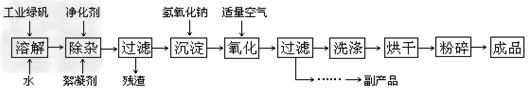
已知:
①?工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应; ?
②?Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O?
③?12.16×1000×52.5%=6384,?6384/152=42
请回答下列问题:
(1)铁的常见氧化物有____________;
(2)Fe3O4与稀硝酸反应的离子方程式是_______________________,检验反应后的溶液中含Fe3+的方法______________________;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是___________________;
(4)生产中可获得的副产品是_______,提取该副产品的操作顺序是____________?(填写序号)
a.过滤?b.加热浓缩?c.冷却?d.结晶?e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16?kg/h,为使产品较纯,鼓入空气的速率应为________?L/h(假设反应在标准状态下进行,空气中O2占20%)。
4、填空题 溴酸钾(KBrO3)为白色晶体,是一种常用的氧化剂和分析试剂,加热到370℃时分解为溴化钾和氧气.生产溴酸钾的工艺流程如下:
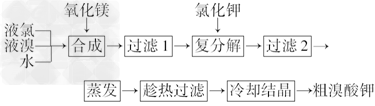
?(1)“合成”过程所发生的反应中,氧化剂是________,还原剂是________.反应的化学方程式为________________________.
(2)“复分解”过程中反应的化学方程式为 ___________________________________.
(3)上述流程中第二次过滤滤出的固体主要成分是 ___________________________.
(4)“趁热过滤”过程中“趁热”的原因是______________________________.
(5)溴酸钾具有毒性,食用少量即可引起呕吐和肾脏的损伤.然而美、日等国都允许在油炸薯片中添加一定量的溴酸钾,以改善薯片的口感.我国也曾允许用作烘焙面包的添加剂,但已于2005年7月开始全国禁止在食品中使用溴酸钾.2007年,一批来自美国的油炸薯片在珠海口岸被我国有关部门检出含有溴酸钾而被禁止入境.从化学原理分析推测,有关国家认为在油炸薯片中添加溴酸钾安全的理由是(用化学方程式表示)____________________,而我国认为不安全的理由是 __________________________________________.
5、填空题 聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·xH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣--铝灰,它主要含
Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下
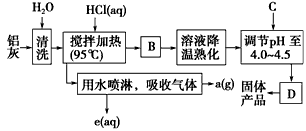
(1)搅拌加热操作过程中发生反应的离子方程式:________________、______________。
(2)生产过程中操作B和D的名称均为________(B和D为简单操作)。
(3)反应中副产品a是________(用化学式表示)。
(4)生产过程中可循环使用的物质是________(用化学式表示)。
(5)调节pH至4.0~4.5的目的是 __________________________。
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程中C物质可选用__________
A.NaOH B.Al C.氨水 D.Al2O3 E.NaAlO2