微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用铂作电极电解一定浓度的下列物质的水溶液.电解结束后,向剩余电解液中加适量水,不能使溶液和电解前相同的是( )
A.AgNO3
B.H2SO4
C.NaOH
D.NaNO3
参考答案:A.电解,阴极生成Ag,阳极生成氧气,向剩余电解液中加适量水,不能使溶液和电解前相同,故A选;
B.电解H2SO4,两极生成的产物是氧气和氢气,相当于电解的水,加入水可使溶液和电解前相同,故B不选;
C.电解NaOH,两极生成的产物是氧气和氢气,相当于电解的水,加入水可使溶液和电解前相同,故C不选;
D.电解NaNO3,两极生成的产物是氧气和氢气,相当于电解的水,加入水可使溶液和电解前相同,故D不选.
故选A.
本题解析:
本题难度:简单
2、填空题 由软锰矿(主要成分为MnO2)制备KMnO4的实验流程可表示如下:
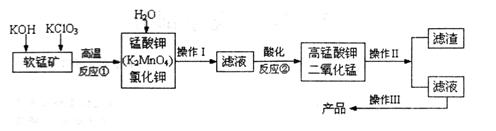
(1)操作Ⅱ的名称是____________。
(2)可循环利用的物质____________(填化学式)。
(3)反应②的产物中,氧化产物与还原产物的物质的量之比是______。
(4)反应②中“酸化”时不能选择下列酸中的______(填字母序号)
A.稀盐酸?B.稀硫酸?C.稀醋酸
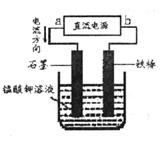
(5)电解猛酸钾溶液也可以得到高锰酸钾,其阴极反应式为:2H2O+2e-=2OH-+H2↑,如下图,b作____________极,电解池的阳极反应式是____________;若电解过程中收集到2.24L H2(标准状况),则得到高锰酸 钾____________克。(提示:阴离子放电顺序MnO42->OH-)
参考答案:(16分)
(1)过滤?(2分)
(2)MnO2?(2分)
(3)2:1?(2分)
(4)A?(2分)
(5)负?(2分),MnO42-—e-=MnO4-?(3分);31.6?(3分)
本题解析:工艺流程题解题的关键是要搞清楚加入什么物质,发生什么反应,如何分离等,通过分析,我们要能够将一个工艺的流程转化为物质的流程。第一步,KOH和KClO3与MnO2反应,得到K2MnO4,从而可以写出反应方程式为6KOH+3MnO2+KClO3=3K2MnO4+KCl+3H2O,然后加入水溶解分离可溶性物质,得到K2MnO4和KCl;第二步,将滤液酸化,得到高锰酸钾和二氧化锰,为一歧化反应,锰从+6变为+7和+4;反应方程式为3MnO42-+4H+=2MnO4-+MnO2+2H2O,通过过滤分离MnO2和高锰酸钾溶液,最终得到产品。整个过程中MnO2可以循环利用。
(4)因锰酸根和高锰酸根均具有强氧化性,不能使用盐酸(具有还原性);
(5)铁为活性电解,这里没有参与反应,做阴极故与负极相连。阳极发生氧化反应,锰酸根失电子生成高锰酸根,根据电子得失守恒可以进行相关计算。
本题难度:困难
3、选择题 pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是( )
A.Na2SO4
B.H2SO4
C.AgNO3
D.NaOH
参考答案:A、电解硫酸钠溶液时,实际上电解的是水,所以溶液中氢离子和氢氧根离子的相对浓度不变,只是硫酸钠的浓度增大,故pH值不变,故A错误;
B、电解硫酸溶液时,实际上电解的是水,但溶液中氢离子的浓度增大,pH值减小,故B错误;
C、电解硝酸银溶液时,阴极上析出银,阳极上得到氧气,所以溶液中的氢氧根离子的浓度减小,氢离子的浓度增大,溶液的pH值减小,故C错误;
D、电解氢氧化钠溶液时,实际上电解的是水,但溶液中的氢氧根离子的浓度增大,氢离子的浓度减小,所以溶液的Pp值增大,故D正确;
故选D.
本题解析:
本题难度:简单
4、实验题 (12分)氯碱工业中电解饱和食盐水的原理示意图如下图所示:

(1)溶液A的溶质是?;
(2)电解饱和食盐水的离子方程式是?;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用?;
(4)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)]。
精致流程如下(淡盐水和溶液A来自电解池):
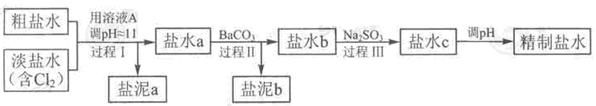
①盐泥a除泥沙外,还含有的物质是?。
②过程Ⅰ中将NH4+转化为N2的离子方程式是?
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有?
④经过程Ⅲ处理,要求盐水中c 中剩余Na2SO3的含量小于5mg /L,若盐水b中NaClO的含量是7.45 mg /L ,则处理10m3盐水b ,至多添加10% Na2SO3溶液?kg(溶液体积变化忽略不计)。
参考答案:(12分,除(1)和①每空1分外,其余每空2分)
(1)NaOH(1分)?(2)2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
(3)氯气与水反应:Cl2+H2O HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出。
HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出。
(4)①Mg(OH)2 ?(1分)? ②2NH4++3Cl2+8OH-=8H2O+6Cl-+N2↑
③SO42-、Ca2+? ④1.76( NaClO具有强氧化性,可将Na2SO3氧化成Na2SO4,方程式为Na2SO3+NaClO=Na2SO4+NaCl。10m3盐水b中含NaClO的物质的量为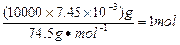 ,由方程式可知消耗Na2SO3的质量为1mol×126g/mol=126g。若设需要10% Na2SO3溶液的质量为X,则有
,由方程式可知消耗Na2SO3的质量为1mol×126g/mol=126g。若设需要10% Na2SO3溶液的质量为X,则有 ,解得x=1760g,即至多添加10% Na2SO3溶液1.76kg。)
,解得x=1760g,即至多添加10% Na2SO3溶液1.76kg。)
本题解析:略
本题难度:简单
5、填空题 钒(v)及其化合物广泛应用于工业催化、新材料和新能源等领域。?
V2O5是接触法制硫酸的催化剂。
( 1)一定条件下,SO2与空气反应tmin后,SO2和SO3物质的量浓度分别为amol/L和bmol/L,则SO2起始物质的量浓度为____mol/L;生成SO3的化学反应速率为____mol/(L·min)。
(2)工业制硫酸,尾气SO2用___吸收。
全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如下图所示。
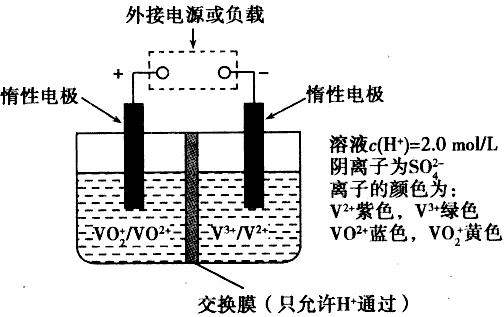
(3)当左槽溶液颜色逐渐由黄变蓝,其电极反应式为____。
(4)充电过程中,右槽溶液颜色逐渐由____色变为____色。
(5)放电过程中氢离子的作用是___和___;充电时若转移的电子数 为3.0l×1023个,左槽溶液中n(H+)的变化量为____。
参考答案:(1)a+b;b/t
(2)氨水
(3)VO2++2H++e- = VO2++H2O
(4)绿;紫
(5)参与正极反应;通过交换膜定向移动使电流通过溶液;0.5 mol
本题解析:
本题难度:一般