微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下表中,对陈述I、II的正确性及两者间有无因果关系的判断都正确的是
[? ]
陈述I
?陈述II
判断
A.
用锌和足量稀硫酸制取氢气时加入硫酸铜溶液
可以制取更多的氢气
I对、II对;有
B.
用Mg-Al-NaOH构成原电池
Mg更活泼作负极
I对、II对;无
C.
AlCl3是离子化合物?
电解熔融的AlCl3制取金属铝
I对、II对;无
D.
石墨常用做电解池的电极?
石墨的化学性质稳定且导电性好
I对、II对;有
参考答案:D
本题解析:
本题难度:一般
2、填空题 下图是氯碱工业中离子交换膜电解槽示意图,其中离子交换膜为“阳离子交换膜”,它有一特殊的性 质--只允许阳离子通过,而阻止阴离子和气体通过。

(1)电解后得到的氢氧化钠溶液从____口流出(填字母代号),b口排出的是____气体,电极1应连接电源的___极(填“正”或“负”);理论上讲,从f口加入纯水即可,但实际生产中,纯水中要加入一定量的NaOH溶液,其原因是____。
(2)下图是根据氯碱工业中离子交换膜技术原理,设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。请回答:
①a为____(填“阳”或“阴”)离子交换膜;
②阳极电极反应式是___ ,
③从D、E口流出或流进的物质的化学式(若为溶液,则写出溶质的化学式)____、____。

参考答案:(1)d; Cl2 ;正; 增强溶液的导电性,又不影响NaOH纯度
(2)①阴;②4OH--4e-==2H2O+O2↑ 或2H2O-4e-== 4H++O2↑ ;③NaOH ;H2O(加少量稀H2SO4)
本题解析:
本题难度:一般
3、选择题 将0.1 L含有0.02mol CuSO4和0.01molNaCl的水溶液用惰性电极电解。电解一段时间后,一个电极上得到0.01 mol Cu,另一电极析出的气体
[? ]
A.只有Cl2?
B.既有Cl2又有O2?
C.只有O2?
D.只有H2
参考答案:B
本题解析:
本题难度:一般
4、选择题 如图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出。符合这一情况的是(?)
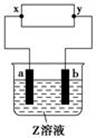
?
| a极板
| b极板
| x电极
| Z溶液
|
A
| 锌
| 石墨
| 负极
| CuSO4
|
B
| 石墨
| 石墨
| 负极
| NaOH
|
C
| 银
| 铁
| 正极
| AgNO3
|
D
| 铜
| 石墨
| 负极
| CuCl2
|
?
参考答案:A
本题解析:用活泼电极或惰性电极电解相同的溶液时现象可能不同。通电后a极板增重,表明溶液中金属阳离子在a极板上放电,发生还原反应析出了金属单质,因此可确定a极板是电解池的阴极,与它相连接的直流电源的x极是负极。故C不正确。A中电解液为CuSO4溶液,阴极a板上析出Cu而增重,阳极b板上由于OH-放电而放出无色无臭的O2,故A正确。B中电解液为NaOH溶液,通电后阴极a上应放出H2,a极板不会增重,故B不正确。D中电解液为CuCl2溶液,阴极a板上因析出Cu而增重,但阳极b板上因Cl-放电,放出黄绿色有刺激性气味的Cl2,故D不正确。
本题难度:一般
5、填空题 某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。

(1)X极与电源的 (填“正”或“负”)极相连,氢气从 (选填“A”、“B”、“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则M为 (填“阴离子”或“阳离子”,下同)交换膜,N为 交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为 。
(4)若在标准状况下,制得11.2 L氢气,则生成硫酸的质量是 ,转移的电子数为 。
参考答案:(1)正 C (2)阴离子 阳离子 (3)H2-2e-+2OH-=2H2O (4)49g 6.02×1023
本题解析:题图中左边加入含硫酸的水,暗示左边制硫酸,即OH-在阳极发生氧化反应,使左边溶液中H+增多,为了使溶液呈电中性,硫酸钾溶液中的SO42-通过M交换膜向左边迁移,即M为阴离子交换膜,由此推知X为阳极,与电源正极相连,B出口产生氧气,A出口流出硫酸;同理,右侧加入含KOH的水,说明右边制备KOH溶液,H+在Y极发生还原反应,说明Y极为阴极,与电源负极相连,右边溶液中OH-增多,硫酸钾溶液中K+向右迁移,N为阳离子交换膜。所以,C出口产生氢气,D出口流出KOH溶液。(3)若将制得的氢气和氧气在氢氧化钾溶液中构成原电池,正极反应式为O2+2H2O+4e-=4OH-,负极反应式为2H2-4e-+4OH-=4H2O。(4)n(H2)=0.5 mol,2H++2e-=H2↑,得电子为1 mol,X极的反应式为4OH--4e-=2H2O+O2↑或2H2O-4e-=4H++O2↑,根据电子守恒知,生成H+的物质的量为1 mol,故生成0.5 mol H2SO4,m(H2SO4)=49 g。
本题难度:一般