| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《物质的量》高频考点特训(2017年练习版)(四)
参考答案:A 本题解析:令稀释后溶液中NaOH的物质量浓度为c,则:30×10-3L×0.5mol/L=500×10-3L×c 本题难度:一般 2、选择题 标准状况下,ag气体A与bg气体B的分子数相同,下列说法错误的是( ) 参考答案:ag气体A与bg气体B的分子数相同,根据N=nNA可知,二者物质的量相等,根据M=mn可知A与B的摩尔质量之比为a:b, 本题解析: 本题难度:一般 3、填空题 (10分)现有m g某气体X2,它的摩尔质量为M? g·mol-1。若阿伏加德罗常数用NA表示,则: 参考答案:m/M ;2mNA/M?;22.4m/M; m/(m+1000) ;m/MV 本题解析:考查物质的量的有关计算。 本题难度:一般 4、选择题 在4mol/L 的硫酸和2mol/L的硝酸混合溶液10mL中,加入0.96g铜粉,充分反应后,最多可收集到标况下的气体的体积为 ( ) |
参考答案:D
本题解析:本题可用如下方法:8H++2NO3-+3Cu=3Cu2++4H20+ 2NO↑
8mol 2mol 3mol 44.8L
0.1mol 0.02mol 0.96/64=0.015mol V
铜不足以铜的量求V, V=0.224L,选D。
本题难度:一般
5、实验题 (1)下列每组中都有一种物质与其他物质在分类上不同,试分析每组中物质的组成规律,将这种不同于其他物质的物质找出来。
①NaCl、KCl、NaClO、BaCl2 ②浊液、溶液、胶体、水
(2)用98%的浓H2SO4(ρ=1.84 g/cm3)配制500 ml0.5 mol/L的稀H2SO4,所需浓H2SO4的体积为_______ml(小数点后保留一位有效数字),如果实验室有10 ml、20 ml、50 ml量筒,应选用 ml量筒;实验中还需要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 ,若实验中出现下列现象,造成所配溶液浓度偏高的有 (填序号)
A.浓硫酸溶解后未冷却至室温即转移至容量瓶进行定容
B.定容时仰视刻度线
C.量取好浓硫酸倒入烧杯溶解后,用水洗涤量筒2-3次,将洗涤液倒入烧杯
(3)把2.0 mol/L CuSO4溶液和1.0 mol/L H2SO4溶液等体积混合(假设混合后溶液的体积等于两溶液的体积之和)。向混合溶液中加入足量的铁粉,经足够长的时间后,铁粉有剩余。此时,溶液中的Fe2+物质的量浓度为 。
参考答案:(1) ①NaClO;②水;(2)13.6ml;20ml ;500ml容量瓶;AC;(3)1.5mol/L
本题解析:(1)①NaCl、KCl、BaCl2都是不含氧的,NaClO里面含氧,NaClO区别其他物质;②浊液、溶液、胶体是混合物,水是纯净物,不同于其他物质;(2)稀释前后溶质的质量不变,V(H2SO4)×1.84×98%=500×10-3×0.5×98,V(H2SO4)=13.6mL,使用量筒应该选用比量取的体积大而接近的,选用20mL;配制H2SO4时,用到的仪器有:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,因此缺少的玻璃仪器是500mL容量瓶;误差的分析,根据c=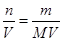 ,A、浓硫酸溶解后未冷却就转移至容量瓶进行定容,热胀冷缩,所配溶液的体积减少,所配浓度偏高,正确;B、定容时仰视刻度线,所配溶液的体积增加,所配浓度降低,错误;C、量筒量取液体后,量筒的洗涤液不能倒入烧杯中,否则溶质质量增加,所配溶液浓度增加,正确,AC符合题意;(3)铁粉过量,反应后溶液中的溶质是FeSO4,设CuSO4溶液的体积是1L,n(Fe2+)=n(SO42-)=1×2+1×1=3mol,c(FeSO4)=
,A、浓硫酸溶解后未冷却就转移至容量瓶进行定容,热胀冷缩,所配溶液的体积减少,所配浓度偏高,正确;B、定容时仰视刻度线,所配溶液的体积增加,所配浓度降低,错误;C、量筒量取液体后,量筒的洗涤液不能倒入烧杯中,否则溶质质量增加,所配溶液浓度增加,正确,AC符合题意;(3)铁粉过量,反应后溶液中的溶质是FeSO4,设CuSO4溶液的体积是1L,n(Fe2+)=n(SO42-)=1×2+1×1=3mol,c(FeSO4)=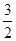 mol·L-1=1.5mol·L-1。
mol·L-1=1.5mol·L-1。
考点:考查物质的分类、配制一定物质的量浓度实验及化学计算。
本题难度:困难
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高中化学知识点讲解《物质的量浓.. | ||