微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 用氯化钠固体配制1.00mol/L的NaCl溶液95mL,回答下列问题
⑴所需仪器为:托盘天平、量筒、烧杯胶头滴管,若要完成实验,还需要两种玻璃仪器为?、?。
⑵该实验的实验步骤为:
①计算,②称量?gNaCl, ③溶解,④移液,⑤洗涤,⑥定容,⑦ 摇匀。
⑶试分析下列操作,对所配溶液的浓度有何影响。(用偏低、偏高、无影响填空)。
①用天平称量氯化钠后,发现砝码底部有锈斑。所配溶液的浓度?;
②为加速固体溶解,微热烧杯溶液并不断搅拌。在未降至20℃时,就将溶液转移至容量瓶定容。所配溶液的浓度?;
③容量瓶不干燥,含有少量蒸馏水。所配溶液的浓度?;
④若定容时仰视刻度线。所配溶液的浓度?;
⑤定容后,加盖、倒转、摇匀后,发现液面低于刻度线,又补加蒸馏水至刻度。则所配溶液的浓度?。
参考答案:⑴100 mL容量瓶?玻璃棒?⑵5.9?⑶①偏高?偏高?无影响?偏低 偏低
本题解析:(1)由于实验室没有95ml容量瓶,所以要用氯化钠固体配制1.00mol/L的NaCl溶液95mL,则需要100ml容量瓶,另外还缺少溶解和转移时的玻璃棒。
(2)需要氯化钠的质量=0.1L×1.00mol/L×58.5g/mol=5.85g≈5.9g。
(3)根据cB=nB/V可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大。①用天平称量氯化钠后,发现砝码底部有锈斑,这说明砝码质量偏大,因此氯化钠的质量偏大,则所配溶液的浓度偏高;②为加速固体溶解,微热烧杯溶液并不断搅拌。在未降至20℃时,就将溶液转移至容量瓶定容,则冷却后容量瓶中溶液的体积偏少,因此所配溶液的浓度偏高;③容量瓶不干燥,含有少量蒸馏水,对所配溶液的浓度不影响;④若定容时仰视刻度线,则容量瓶中溶液的体积偏大,因此所配溶液的浓度偏低;⑤定容后,加盖、倒转、摇匀后,发现液面低于刻度线,又补加蒸馏水至刻度,则容量瓶中溶液的体积偏大,因此所配溶液的浓度偏低。
本题难度:一般
2、选择题 (8分)同温同压下,同体积的H2和CO2物质的量之比为?,原子个数之比?,质量比?;若两者所含原子个数相等,它们的物质的量比是?。
参考答案:(8分)1:1 ,2:3 ,1:22 ;3:2 。
本题解析:略
本题难度:一般
3、选择题 若用NA表示阿伏加德罗常数,下列叙述正确的是
A.22.4 L NH3中含氮原子数为 NA
B.1 mol Na2O2与水完全反应时转移的电子数为NA
C.100 mL 2.0 mol·L-1 NH4HCO3溶液中NH4+ 数为0.2NA
D.1 mol O2和2 mol SO2在密闭容器中充分反应后的分子数等于2NA
参考答案:B
本题解析:A:在没有标明压强与温度的情况下气体的体积没有意义;B:Na2O2与水反应发生自身氧化还原反应,1 mol Na2O2转移的电子数为NA;C:NH4HCO3溶液中NH4+ 部分水解;D:两者发生可逆反应2SO2+O2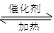 2SO3,不可能进行到底。故选B
2SO3,不可能进行到底。故选B
本题难度:一般
4、选择题 在1 L 1mol?L-1的氨水中( )
A.含1 mol NH3分子
B.含NH3、NH4+之和为1 mol
C.含1 mol NH3?H2O
D.含NH3、NH3?H2O、NH4+之和为1 mol
参考答案:D
本题解析:氨水是弱碱,部分电离,所以NH3和NH3·H2O物质的量均小于1mol,A、C错误;由氮元素守恒知NH3、NH3?H2O、NH4+之和为1 mol,D正确、B错误。
点评:NH3+H2O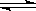 NH3·H2O
NH3·H2O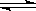 NH4++OH-
NH4++OH-
本题难度:一般
5、选择题 只给出下列甲和乙中对应的物理量,能求出物质的量的是
A.甲:物质中的粒子数;乙:阿伏加德罗常数
B.甲:标准状况下的气体摩尔体积;乙:标准状况下的气体的体积
C.甲:固体的体积;乙:固体的密度
D.甲:溶液中溶质的物质的量浓度;乙:溶液体积
参考答案:ABD
本题解析:A、物质的量等于粒子数除以阿伏伽德罗常数;
B、物质的量的体积除以摩尔体积;
C、不行;
D、物质的量的浓度乘以体积。
本题难度:简单