微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 有Na2SO4和Na2CO3混合溶液10.0mL,加入足量BaCl2溶液,充分反应后,经过滤、洗涤、烘干,得到白色沉淀1.45g,将沉淀与过量的盐酸反应,得到112mLCO2气体(标况)。求原混合溶液中Na2SO4和Na2CO3的物质的量浓度。(写出必要的计算过程,只有答案没有过程不给分)
参考答案:n(Na2CO3)= n(BaCO3)= n(CO2)=0.112L÷22.4mol/L=5×10-3mol
n(Na2SO4)= n(BaSO4)="[1.45g-" n(BaCO3)·M(BaCO3)] ÷M(BaSO4)
=(1.45g- 5×10-3mol×137g·mol-1)÷233 g·mol-1
?=3.3×10-3mol
c(Na2CO3)= 5×10-3mol÷0.1L="0.05" mol·L-1?(3分)
c(Na2SO4)= 3.3×10-3mol÷0.1L="0.033" mol·L-1?(4分)
(其它合理运算同样给分)
本题解析:略
本题难度:简单
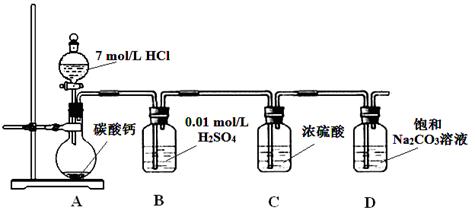
2、实验题 (11分)为证明有关物质的性质,某学生设计了如图所示的装置。当打开活塞C,使液体A与隔板H上的固体B相遇时,即有气体产生,并发现D中蜡烛熄灭;关闭C 打开E时,则看到G中蜡烛燃得更亮。
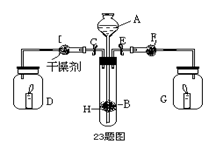
(1)请判断各仪器中盛放的物质的化学式:
A?; B?;F??。
(2)用化学反应方程式表示上述有关反应(不包括蜡烛的燃烧):?
??,
??,
??.
参考答案:(1)A .HCl? B.CaCO3? F.Na2O2
(2)CaCO3+2HCl = CaCl2+H2O+CO2↑; 2Na2O2+2CO2 = 2Na2CO3+O2?;2Na2O2+2 H2O? = 4NaOH+O2
本题解析:D中蜡烛熄灭,说明试管中生成了二氧化碳气体,试管中发生的反应是实验室制取二氧化碳气体的反应;G中蜡烛燃烧更旺,说明G中生成了氧气,应是二氧化碳与过氧化钠发生反应,二氧化碳气体通过过氧化钠时气体未干燥,所以还有过氧化钠与水蒸气的反应。
(1)A、B、F分别为HCl、CaCO3、Na2O2。
(2)有关反应方程式为CaCO3+2HCl = CaCl2+H2O+CO2↑; 2Na2O2+2CO2 = 2Na2CO3+O2?;2Na2O2+2 H2O? = 4NaOH+O2↑。
点评:二氧化碳气体通过过氧化钠时没有用干燥剂干燥二氧化碳气体,所以二氧化碳气体中混有水蒸气,当然应该还有氯化氢与过氧化钠的反应。
本题难度:一般
3、选择题 下列说法正确的是(?)
A.Na2CO3比NaHCO3的溶解度小
B.质量相同的Na2CO3和NaHCO3与足量盐酸反应可生成等量的CO2
C.石灰水可鉴别Na2CO3和NaHCO3溶液
D.Na2CO3和NaHCO3同时与质量分数相等.质量相等的盐酸反应,后者放出气体快
参考答案:D
本题解析:A、相同的温度下,碳酸钠的溶解度大于碳酸氢钠的,A错误;B直接利用化学方程式进行计算,假设Na2CO3、NaHCO3的质量都为1g,则:
设1克Na2CO3与足量的盐酸反应,生成的二氧化碳气体的质量为x,
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106? 44
1g? x
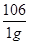 =
=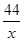
x=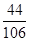 g
g
设1克NaHCO3与足量的盐酸反应,生成的二氧化碳气体的质量为y.
NaHCO3+2HCl═2KCl+H2O+CO2↑
84? 44
1g? y
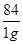 =
=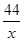
x=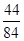 g
g
C、加入澄清的石灰水,Na2CO3溶液和NaHCO3溶液都能生成CaCO3沉淀,不能区别两种溶液,C错误;
D、盐酸的物质的量浓度相等,分别滴加HCl溶液,反应离子方程式为CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,NaHCO3反应速率快,D正确;选D。
本题难度:一般
4、选择题 美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是?(?)
A.铝钠合金是混合物
B.铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na)
C.铝钠合金投入到足量氯化铜溶液中,会有氢氧化铜沉淀也可能有铜析出
D.若m g不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小
参考答案:D
本题解析:D、假设mg全部是钠,放出的氢气为m/46mol;全部为铝,放出的气体为m/18mol。故铝的质量分数越多,放出的氢气越多。
本题难度:一般
5、实验题 Ⅰ.某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3,装置如图所示(气密性已检验,部分夹持装置略):
(1)请结合化学平衡移动原理解释B中溶液的作用?。
(2)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤,取一定量配成样液,并加入BaCl2溶液,出现白色沉淀并有气体产生,其离子方程式是?。
Ⅱ.某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如下实验(夹持装置未画出)进行实验。请回答下列问题:
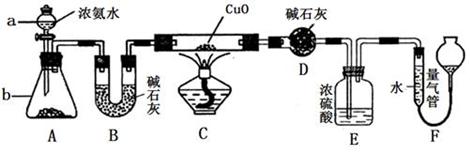
(1)仪器b中可选择的试剂为(任意填一种)?。
(2)实验中,装置C中黑色CuO粉末全部转化为红色固体(已知Cu2O也为红色固体),量气管中有无色无味的气体。实验前称取黑色CuO 80g,实验后得到红色固体质量为68g。则红色固体成分的化学式为?。
(3)F中读取气体体积前,应向上或向下移动右管,使得左右两边液面相平,若无此操作,而F中左边液面低于右边液面,会导致读取的气体体积??(填“偏大”或“偏小”或“无影响”)。
(4)要想测得氨气分子中氮、氢原子个数比,实验中应至少测量或读取哪些数据?(填序号)。
a.B装置实验前后质量差mg;? b.F装置实验前后液面差VL
c.D装置实验前后质量差mg;? d.E装置实验前后质量差mg;
(5)E装置中浓硫酸的作用是?。
参考答案:Ⅰ.(1)CO2在水中存在平衡:CO2+H2O H2CO3
H2CO3 HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体(3分)[给分要点:吸收HCl气体、减少CO2在水中的溶解、H2SO4电离出的H+使平衡左移]
HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体(3分)[给分要点:吸收HCl气体、减少CO2在水中的溶解、H2SO4电离出的H+使平衡左移]
(2)2HCO3-+Ba2+=BaCO3↓+ CO2↑+H2O(3分)
Ⅱ.(1)碱石灰或生石灰或氢氧化钠固体(任意填一种)(2分)
(2)Cu和Cu2O(3分)?(3)偏小(2分)?(4)b、c(3分)
(5)防止F中水蒸气进入D中,并吸收氨气(2分)
本题解析:Ⅰ.(1)7mol?L?1的盐酸与CaCO3反应制取的CO2气体中含有HCl,硫酸溶液可吸收HCl,CO2能溶于水,存在平衡::CO2+H2O H2CO3
H2CO3 HCO3-+H+,H2SO4电离产生H+,使上述平衡向左移动,从而减少CO2在水中的溶解。
HCO3-+H+,H2SO4电离产生H+,使上述平衡向左移动,从而减少CO2在水中的溶解。
(2)当D中有大量白色固体析出时,CO2、H2O与Na2CO3反应生成了NaHCO3,加入BaCl2溶液,出现白色沉淀为BaCO3,产生的气体为CO2,离子方程式为:2HCO3-+Ba2+=BaCO3↓+ CO2↑+H 2O
Ⅱ.(1)碱石灰或生石灰或氢氧化钠固体都能与浓氨水作用,产生氨气。
(2)若CuO全部被还原为Cu,根据关系式:CuO ~ Cu,生成的Cu质量为:80g×64/80=64g;若CuO全部被还原为Cu2O,根据关系式:2CuO ~ Cu2O,生成的Cu2O质量为:80g×144/160=72g,实际得到红色固体质量为68g,则红色固体成分为Cu和Cu2O
(3)F中左边液面低于右边液面,说明左边气体压强大于右边,则会导致读取的气体体积偏小。
(4)F装置实验前后液面差VL,为NH3与CuO反应生成的N2的体积,可求出N原子的物质的量,D装置实验前后质量差mg,为NH3与CuO反应生成的H2O的质量,可求出H原子的物质的量,由二者可求出氨气分子中氮、氢原子个数比。
(5)因为D中碱石灰的作用是吸收NH3与CuO反应生成的H2O,所以E中浓硫酸可F中水蒸气进入D中,并吸收未反应的氨气。
本题难度:困难