微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 某校学生用如下图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。
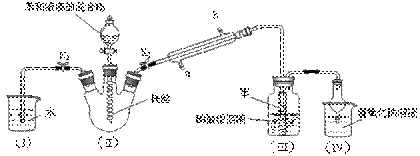
请回答下列问题:
(1)写出II中反应的化学方程式?。
(2)观察到II中的现象是?。
(3)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。III中小试管内苯的作用是?。
(4)能说明苯与液溴发生了取代反应的现象是?。
(5)将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
①用蒸馏水洗涤,振荡,分液;②用5%的NaOH溶液洗涤,振荡,分液;
③用蒸馏水洗涤,振荡,分液;④加入无水CaCl2粉末干燥;
⑤?(填操作名称)。
参考答案:
本题解析:略
本题难度:简单
2、实验题 (14分)
室温下,已知HCl溶液与NaOH溶液的酸碱滴定曲线如下图所示:
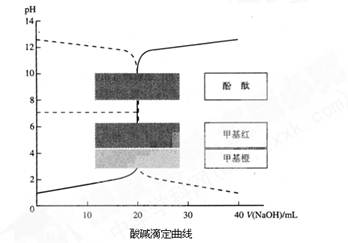
(1)向一定量的NaOH溶液中滴加HCl溶液的曲线为图中??(填“实线”或“虚线”)。
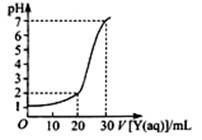
(2)上图为对10mL一定物质的量浓度的NaHSO4溶液X用一定物质的量浓度的氢氧化钠溶液Y滴定的图象,依据图象推出X和Y的物质的量浓度分别是?和?。
(3)某研究性学习小组的研究课题:食醋中总酸量(g/100mL)的测定。他们进行以下滴定操作:
A.取某品牌白醋25.00mL置于?(填仪器名称)中,用蒸馏水稀释10倍。
B.用?(填仪器名称)量取稀释后的白醋溶液20.00mL,置于250mL锥形瓶中,滴入?(填指示剂名称)1~2滴。
C.用0.05 mol·L?1NaOH标准溶液滴定,至终点。记下初始与终点读数。
(注意:滴定重复进行3次。)
根据以上操作,请你继续回答下列问题。
①操作(C)中,滴定时,两眼注视?;终点现象是?。
②误差分析:下列操作中能使测定结果偏高的是?。
a.稀释白醋的蒸馏水预先未经过煮沸处理
b.盛NaOH溶液的碱式滴定管未用标准液润洗
c.滴定前读数正确,滴定终点时俯视读数
d.接近终点时,用少量蒸溜水洗涤锥形瓶
③如果该小组检测结果与该品牌商标上所注不一致,可能的原因之一是?。
参考答案:(14分)
(1)虚线?(2分)?(2)0.09 mol·L?1? 0.03 mol·L?1?(每空2分)
(3)(A)250mL容量瓶(1分)
(B)酸式滴定管(1分),酚酞试液(1分)
①锥形瓶中溶液颜色的变化。(1分)
溶液由无色变为浅红色,且在30s内不褪色。(1分)
②a、b(2分)
③食醋稀释时,体积控制不当,实际稀释倍数大于理论释释倍数;试样量取体积偏小;滴定终点颜色不足30s褪去;滴定结束后在碱式滴定管的尖嘴处有气泡;制造商加水过度稀释等。(1分)
本题解析:考查酸碱中和滴定
(1)向一定量的NaOH溶液中滴加HCl溶液时,混合溶液的pH逐渐减小,故符合虚线
(2)设X和Y的物质的量浓度分别CX、CY,根据图示可得到以下两等式:
0.01CX=0.03CY? 0.01=(0.01CX—0.02CY)/0.03
解得:CX=0.09 mol·L?1、CY=0.03 mol·L?1
(3)A:精确的配制、稀释溶液的容器为容量瓶
B:精确量取酸性液体可采用酸式滴定管;由于用强碱滴定弱酸,中和时溶液水解呈碱性,最好采用变色范围为碱性区域的指示剂,即酚酞
C:①酸碱滴定时,左手握活塞,右手旋转锥形瓶,两眼注视锥形瓶中溶液颜色的变化;
终点现象是溶液由无色变为浅红色,且在30s内不褪色
②a.蒸馏水消毒时一般用氯气,形成酸性物质,故将消耗的碱液偏多,测定结果偏高
b.盛NaOH溶液的碱式滴定管未用标准液润洗将使标准液的浓度偏小,标准液的体积偏大,测定结果偏高
c.滴定前读数正确,滴定终点时俯视读数,将使标准液的体积偏小,测定结果偏低
d.无影响
③制造商加水过度稀释等
本题难度:一般
3、实验题 (12分)温度对化学反应速率影响的实验探究根据下图所给出的仪器和药品进行实验。

操作方法:在三支相同的试管中分别加入2 mL—3 mL约5%的H2O2,然后在每支试管中滴加2滴1 mol·L-1的FeCl3溶液后立即套上气球(大小相同)。等三支试管上的气球大小差不多相同时,同时置于三个烧杯中观察现象。
实验现象为___________________________________________________________________。
实验结论为___________________________________________________________________。
参考答案:气球膨胀的由快到慢的顺序为左→中→右
升高温度加快反应速率,降低温度减慢反应速率
本题解析:H2O2在不同温度下的分解速率不同,很明显,温度越高,反应速率越快,FeCl3在此作催化剂。
本题难度:简单
4、填空题 为探究乙烯与溴的加成反应:甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯,将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应.乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量浓硫酸的还原气体,由此他提出必须先除去,再与溴水反应.
请你回答下列问题:
(1)甲同学设计的实验______(填“能”或“不能”)验证乙烯与溴水发生了加成反应,理由是______.
(2)乙同学推测此乙烯中必定含有的一种杂质气体,它与溴水反应的化学方程式是______.在验证过程中必须全部除去,为此乙同学设计了如图所示的实验装置:
①Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是Ⅰ______;Ⅱ______;Ⅲ______;Ⅳ______;
(选填序号).
A.品红溶液B.NaOH溶液C.浓硫酸D.酸性KMnO4溶液
②乙设计的实验中能确定生成了乙烯的现象是______.
(3)为验证乙烯与溴水的反应是加成反应而不是取代反应,丙同学提出可将上述乙除杂后的气体通入溴水中,用pH试纸测反应后溶液的酸碱性,你认为是否合理______(填合理、不合理),理由是______.
(4)乙烯通入溴水中,观察到的现象是______;其反应方程式为______.

参考答案:(1)乙醇和浓硫酸反应,在一定条件下可以生成乙烯、乙醚,同时可能生成二氧化硫等还原性气体,使酸性高锰酸钾溶液褪色,对乙烯的检验造成干扰,所以甲同学的实验不能说明乙烯与溴水发生加成反应,
故答案为:不能;乙醇和浓硫酸为原料制取乙烯时,生成的气体中可能含有二氧化硫,二氧化硫也能使溴水褪色;
(2)二氧化硫、溴水发生氧化还原反应生成硫酸和氢溴酸,反应方程式为2H2O+Br2+SO2=H2SO4+2HBr,故答案为:2H2O+Br2+SO2=H2SO4+2HBr;
①验证过程中必须排除二氧化硫的干扰,所以先除去二氧化硫,I中盛放品红溶液检验二氧化硫、II中盛放氢氧化钠溶液除去二氧化硫、III中盛放品红溶液检验二氧化硫是否除尽,IV中盛放酸性高锰酸钾检验乙烯的性质,故答案为:A;B;A;D;
②III中溶液不褪色,说明剩余气体中不含二氧化硫,IV中酸性高锰酸钾溶液褪色,说明乙烯能使酸性高锰酸钾褪色,故答案为:III中品红溶液不褪色,IV中酸性高锰酸钾溶液褪色;
(3)若乙烯和溴发生取代反应,则该反应中有溴化氢生成,用pH试纸测反应后溶液应该呈酸性,如果溶液没有呈酸性,则证明发生加成反应,所以丙同学的设计合理,
故答案为:合理;若发生取代反应,必有溴化氢生成,溶液呈酸性;
(4)溴和乙烯发生加成反应生成1,2-二溴乙烷,且1,2-二溴乙烷密度较大,所以下层有无色油状液体生成,反应方程式为:CH2=CH2+Br2→CH2BrCH2Br,
故答案为:溴水褪色,下层有无色油状物生成;CH2=CH2+Br2→CH2BrCH2Br.
本题解析:
本题难度:一般
5、实验题 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
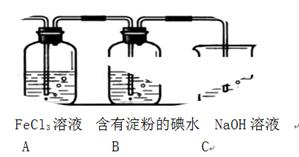
(1)SO2气体还原Fe3+的产物是?(填离子符号),参加反应的SO2和Fe3+的物质的量之比是?。
(2)下列实验方案适用于在实验室制取所需SO2的是?(填序号)。
A.Na2SO3溶液与HNO3? B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧?D.硫铁矿在高温下与O2反应
(3)装置C的作用是?。
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有?(填序号)。
A.蒸发皿? B.石棉网? C.漏斗? D.烧杯? E.玻璃棒? F.坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是?,原因是?。
(6)能表明I-的还原性弱于SO2的现象是?。
参考答案:(16分)(1)SO42-、Fe3+; 1︰2?(2)B
(3)吸收SO2尾气,防止污染空气?(4)BF
(5)方案①,因为A的溶液中含有SO2,SO2也能使KMnO4溶液褪色
(6)B中蓝色溶液褪色 (每空2分)
本题解析:(1)SO2气体还原Fe3+的产物是SO42-和Fe3+,反应的方程式是SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,参加反应的SO2和Fe3+的物质的量之比1︰2。
(2)硝酸具有氧化性,和亚硫酸钠反应得不到SO2;Na2SO3固体与浓硫酸反应生成SO2,B正确;选项CD中虽然可以生成SO2,但得到但气体不是纯净物,很难分离,答案选B。
(3)SO2是大气污染物,所以C装置的作用是吸收SO2尾气,防止污染空气。
(4)溶液加热浓缩应该用蒸发皿,不能用坩埚,且不需要垫石棉网,因此答案选BF。
(5)由于A的溶液中含有SO2,SO2也能使KMnO4溶液褪色,所以方案①是不合理的。
(6)SO2能使单质碘还原,即B中蓝色溶液褪色就可以说明I-的还原性弱于SO2的。2性质探究实验的有关判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生实验能力的和解题方法的指导与训练,有利于培养学生规范、严谨的实验设计和评价能力,提升学生的学科素养。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般