微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某原电池反应的离子方程式为:Fe+2H+=Fe2++H2↑,则下列说法正确的是(?)
A.HNO3为电解质溶液
B.锌为原电池正极
C.铁极质量不变
D.铜为原电池正极
参考答案:D
本题解析:由电池反应的离子方程式知,负极为铁,则正极应是比铁不活泼的金属,B选项错。在反应中负极不断被消耗,C选项错。由于反应放出了氢气并生成了Fe2+,故知电解质溶液不能是HNO3。由上分析可知正确选项为D。
本题难度:一般
2、选择题 普通水泥在固化过程中自由水分子减少并产生Ca(OH)2,溶液呈碱性。根据这一特点科学家发明了电动势(E)法测水泥初凝时间,此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag。下列有关说法不正确的是

A.工业上制备普通水泥的主要原料是黏土和石灰石
B.测量原理装置图中,Ag2O/Ag极发生氧化反应
C.负极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O
D.在水泥固化过程中,由于自由水分子的减少,溶液中各离子浓度的变化导致电动势变化
参考答案:B
本题解析:原电池中相对活泼的电极为负极,失电子,发生氧化反应,所以本电池中铜极发生氧化反应:2Cu+2OH--2e-=Cu2O+H2O,而Ag2O/Ag极做正极,发生还原反应,故选B
本题难度:一般
3、填空题 高铁酸钠的化学式为Na2FeO4,按要求回答下列问题:
(1)高铁酸钠主要通过如下反应制取:
 ,则X的化学式为_____________。
,则X的化学式为_____________。
(2)高铁酸钠是一种新型净水剂,在水中可以发生如下反应:
 。由此看来,高铁酸钠能够杀菌消毒是因为它具有________性,而能够除去水中悬浮物是因为__________。
。由此看来,高铁酸钠能够杀菌消毒是因为它具有________性,而能够除去水中悬浮物是因为__________。
(3)FeO42-在水溶液中的存在形态如图所示。向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为___________________。

(4)高铁电池是一种新型可充电电池,电解池为碱溶液,其反应式为
 则电池正极材料是_________,充电时电池正极________(填“得”“失”)电子,放电时电池的负极反应式为___________。
则电池正极材料是_________,充电时电池正极________(填“得”“失”)电子,放电时电池的负极反应式为___________。
参考答案:(1)NaCl
(2)氧化性;生成的Fe(OH)3,在水中形成胶体能吸附水中的悬浮杂质
(或 )
)
(3)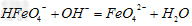
(4)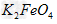 ;失;
;失;
本题解析:
本题难度:一般
4、填空题 (18分)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
(1)V2O5是接触法制硫酸的催化剂。? ’?
①已知25℃.10lkPa时:
2SO2(g)+O2(g)+2H2O(1)=2H2SO4(1)?△H = -457kJ·mol-l
SO3(g)+H2O(1)=H2SO4(1) △H= -130kJ·mol-l
 ?则反应2SO2(g)+O2(g)? 2SO3(g)的△H=?kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能?(填“增大”、“不变”或“减小”)。
?则反应2SO2(g)+O2(g)? 2SO3(g)的△H=?kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能?(填“增大”、“不变”或“减小”)。
②SO2水溶液可与SeO2反应得到硫酸,当有79gSe生成时,转移电子的物质的量为?mol,此反应的化学方程式是?。
(2)全钒液流电池的结构如图所示,其电解液中含有钒的不同价态的离子、H+和SO42-。电池放电时,负极的电极反应为:
V2+-e一=V3+。
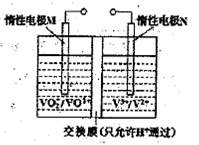
①电池放电时的总反应方程式为?。
充电时,电极M应接电源的?极。
②若电池初始时左、右两槽内均以VOSO4和H2SO4的混合液为电解液,使用前需先充电激活,充电过程阴极区的反应分两步完成:第一步VO2+转化为V3+;第二步V3+转化为V2+。则第一步反应过程中阴极区溶液n(H+)?(填“增大”、“不变”或“减小”),阳极的电极反应式为:?。
参考答案:(18分)
(1)①—197(2分)?减小(2分)
② 4(2分)? 2SO2+SeO2+2H2O=2H2SO4+Se(2分)
(2)①VO2++V2++2H+=VO2++V3++H2O(3分) 正极(2分)
②减小(2分) VO2++ H2O—e?= VO2++2H+(3分)
本题解析:(1)①根据盖斯定律,2SO2(g)+O2(g) 2SO3(g)的△H= -457kJ·mol-l—2×(-130kJ·mol-l)=—197 kJ·mol-l;使用催化剂,降低活化能,使反应速率加快。
2SO3(g)的△H= -457kJ·mol-l—2×(-130kJ·mol-l)=—197 kJ·mol-l;使用催化剂,降低活化能,使反应速率加快。
②Se元素由+4价降低为0,所以当有79gSe生成时,转移转移电子的物质的量为:79g÷79g/mol×4=4mol;根据氧化还原反应规律,SO2、SeO2、H2O反应生成H2SO4和Se,配平可得化学方程式:2SO2+SeO2+2H2O=2H2SO4+Se
(2)①根据电池结构图,正极上VO2+得电子生成VO2+,所以放电时的总反应方程式为:VO2++V2++2H+=VO2++V3++H2O;电极M为电池的正极,充电时应接电源的正极。
②第一步VO2+转化为V3+的电解方程式为:VO2++4H++2e?= V3++2H2O,消耗了H+,所以阴极区溶液n(H+)减小;阳极上VO2+失电子生成VO2+,所以电极方程式为:VO2++ H2O—e?= VO2++2H+。
本题难度:一般
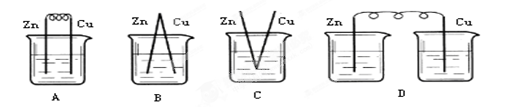
5、选择题 下列烧杯中盛放的都是稀硫酸,在铜棒上不能产生气泡的是( )
参考答案:D
本题解析:原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应。原电池中正极上发生还原反应,负极上发生氧化反应。A、B、C三个装置中均构成构成原电池,铜作正极,正极上氢离子得电子生成氢气;D、该装置没有形成闭合回路,所以铜极上没有气泡产生,所以正确的答案选D。
考点:考查原电池的判断及电极反应
点评:该题是高考中的常见考点,属于基础性试题的考查,难度不大。明确原电池的工作原理、构成条件是答题的关键。
本题难度:简单