| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《盐类水解的原理》试题强化练习(2017年最新版)(四)
参考答案:B 本题解析:①CH3COONa 强碱弱酸盐,13>PH>7,②NaOH强碱,PH=13,③NaCl,强酸强碱盐,PH=7, ④NH4Cl强酸弱碱盐,PH<7,溶液的pH由大到小的顺序是②>①>③>④,选B。 本题难度:一般 3、选择题 将标况下的2.24LCO2通入150mL 1mol/LNaOH溶液中,下列说法正确的是 |
参考答案:C
本题解析:标况下的2.24LCO2的物质的量为0.1mol;150mL 1mol/LNaOH溶液的物质的量为0.15mol,设反应后溶液中碳酸钠的物质的量为x,碳酸氢钠的物质的量为y;根据C元素守恒可得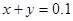 ;根据Na元素守恒可得
;根据Na元素守恒可得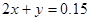 ;解得
;解得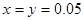 ,由于在溶液中碳酸根离子、碳酸氢根离子均要水解且碳酸根离子的水解程度大于碳酸氢根离子,所以正确选项为C;
,由于在溶液中碳酸根离子、碳酸氢根离子均要水解且碳酸根离子的水解程度大于碳酸氢根离子,所以正确选项为C;
本题难度:一般
4、选择题 下列浓度关系正确的是( )
A.氯水中:c(Cl2)=2[C(ClO--) + C(Cl--) + C(HClO)]
B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-) + C(OH--)
D.Na2CO3溶液中:c( Na+)>c(CO)>c(OH-)>c(HCO)>c(H+)
参考答案:D
本题解析:A 错误,氯元素主要以氯气形式存在在水中
B 错误, c(H+)>c(Cl-) >c(ClO-)>c(OH-)
C 错误,c(H+)+c(Na+)=c(CH3COO-) + C(OH--)
D 正确。
本题难度:一般
5、选择题 常温下,向20mL 0.lmol?L-1的草酸(H2C204)溶被中不断滴入0.lmol?L-1的KOH溶液,溶液的pH变化曲线如图所示。下列有关说法正确的是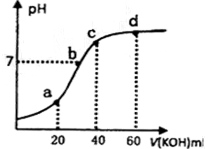
A.a点溶液呈酸性,是因为HC2O4-的电离程度小于其水解程度
B.b点:c(K+)=c(H2C2O4-)+2c(C2O42-)
C.c点:c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
D.d点:c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+)
参考答案:B
本题解析:A.a点溶液二者恰好反应产生KHC2O4,溶液中同时存在HC2O4-的电离作用和水解作用,电离是溶液显酸性,水解使溶液显碱性。而a碘溶液呈酸性是因为HC2O4?的电离程度大于其水解程度,错误;B.b点时溶液是KHC2O4和K2C2O4的混合物。溶液呈中性,即有c(H+)=c(OH?),根据电荷守恒有c(K+)+c(H+)=c(HC2O4?)+2c(C2O42?)+c(OH?),故有c(K+)=c(HC2O4?)+2c(C2O42?),正确;c点是草酸与KOH恰好中和反应生成K2C2O4,根据物料守恒有c(K+)=2c(H2C2O4)+2c(HC2O4?)+2c(C2O42?),错误;D.d点是反应后得到的等物质的量的K2C2O4和KOH的混合液,由于C2O42?水解消耗,同时还产生OH?,应是c(OH?)>c(C2O42?),错误。
考点:考查酸碱混合溶液中离子浓度大小比较的知识。
本题难度:困难
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学知识点归纳《原电池原理.. | ||