微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 海水是巨大的资源宝库。从海水中提取食盐和溴的过程如下:
?
 (1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br?,其目的为富集溴元素,请写出步骤Ⅱ的化学方程式,并用双线桥法标出电子转移的方向与数目。(4分)
(1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br?,其目的为富集溴元素,请写出步骤Ⅱ的化学方程式,并用双线桥法标出电子转移的方向与数目。(4分)
?
 (2)
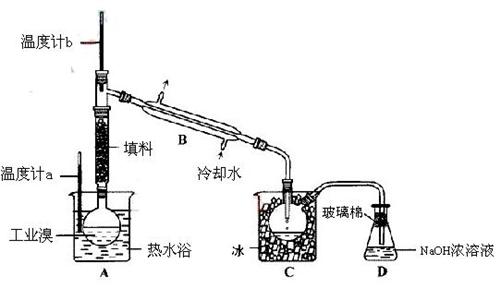
(2) 某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下装置简图:
某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下装置简图:

 请你参与分析讨论:
请你参与分析讨论:

 ①图中仪器B的名称: 。(1分)
①图中仪器B的名称: 。(1分)
 ②
②  实验装置气密性良好,要在C中获得纯净的液溴即达到提纯溴的目的,操作中如何控制关键条件: ? 。(2分)
实验装置气密性良好,要在C中获得纯净的液溴即达到提纯溴的目的,操作中如何控制关键条件: ? 。(2分)
 ③为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,则发生的反应方程式为
③为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,则发生的反应方程式为
?(2分)
充分反应后,再进行的分离操作是 ? 。(1分)
2、选择题 下列关于氯气的叙述正确的是
[? ]
A.钠在氯气中燃烧产生白色烟雾
B.红热的铜丝可以在氯气中燃烧,产生棕黄色烟雾
C.纯净的氢气可以在氯气中安静地燃烧,发出苍白色火焰
D.氯气可用于漂白,这是氯气的漂白作用
3、填空题 亚氯酸钠(NaClO2)是一种重要的化工原料,以下是过氧化氢法生产亚氯酸钠的工艺流程图:
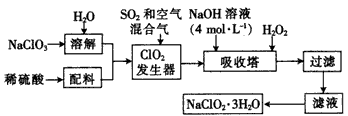
已知:
①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下更安全。
试回答下列问题:
(1)ClO2发生器中发生反应的离子方程式为____。
(2)在ClO2发生器中通入空气的作用是____(填字母)。
A.将SO2氧化成SO3,增强酸性
B.稀释ClO2以防止爆炸
C.将NaClO3氧化成ClO2
(3)吸收塔内的温度不能超过20℃,其主要目的是______,吸收塔内发生反应的化学方程式为____。
(4)在碱性溶液中NaClO3比较稳定,在酸性溶液中,ClO2-和H+结合为HClO2,HClO2是唯一的亚卤酸,不稳定,易分解产生Cl2、ClO2和H2O,写出HClO2分解的化学方程式:____。
4、选择题 下列反应中,为了制等量的氯气,起还原作用的HCl最少的是( )
A.MnO2+浓HCl
B.KMnO4+HCl
C.KClO3+HCl
D.电解盐酸(惰性电极)
5、选择题 不能使湿润的碘化钾淀粉试纸变蓝的是
A.氯水
B.碘水
C.次氯酸溶液
D.碘化钾溶液