| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《化学反应与能量》考点强化练习(2017年押题版)(四)
参考答案:A 本题解析:A正确,搅拌可加快反应速率,减小热量损耗;B错,实验中温度计水银球不能与小烧杯底部接触;C错,盐酸为强酸而醋酸为弱酸,弱酸电离要吸收能量,两者所测中和热数值不同;D错,在测定中和热实验中没有使用到天平; 本题难度:一般 2、选择题 下列叙述正确的是 |
参考答案:C
本题解析:A、熵变小于零即△S<0,焓变大于零即△H>0,△G=△H-T△S>0,反应不自发进行,不代表反应不能发生,错误;B、热化学方程式中ΔH的值与反应物的用量无关,与热化学方程式中反应物的系数有关,错误;C、化学反应中旧键断裂吸收能量,新键形成释放能量,但遵循能量守恒定律,反应前后物质的总能量不变,所以化学反应伴随能量变化,正确;D、醋酸的稀释过程中,氢离子、醋酸根离子的浓度减小,但氢氧根离子的浓度增大,错误,答案选C。
考点:考查反应自发的判断,热化学方程式与热效应的关系,溶液稀释过程离子浓度的变化
本题难度:一般
3、选择题 在同温同压下,下列各组热化学方程式中, △H1>△H2的是
A.2H2(气)+O2(气)=2H2O(气) △H1 2H2(气)+O2(气)=2H2O(液) △H2
B.S(气)+O2(气)=SO2(气) △H1 S(固)+O2(气)=SO2(气) △H2
C.C(固)+O2 (气)=CO2(气) △H1 C(固)+1/2O2(气)=CO(气) △H2
D.H2(气)+Cl2(气)=2HCl(气) △H1 1/2H2(气) +1/2Cl2(气)=HCl(气) △H2
参考答案:A
本题解析:物质的聚集状态从固态、液态、气态能量增高,化学反应中放出热量越多,焓变越负,答案选A。
考点:热化学方程式、焓变
本题难度:一般
4、填空题 氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al与NaOH溶液反应的离子方程式为 。
(2)下列实验能比较镁和铝的金属性强弱的是 (填序号)。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/LAlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al (s)+3O2(g) =2Al2O3(s) ΔH1 =" -3352" kJ/mol
Mn(s)+ O2(g) =MnO2 (s) ΔH2 =" -521" kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是 。
(4)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,其反应方程式为 。
(5)工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g) + 2N2(g) + 6H2(g)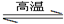 Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是 mol/(L·min)。
②若按n(SiCl4) : n(N2) : n(H2) =" 3" : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应 (填“增大”、“减小”或“不变”)。
(6)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4的溶度积表达式为Ksp= 。
为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10-5mol·L-1,需调节pH为 以上。
参考答案:(1)2Al +2OH-+6H2O = 2[Al(OH)4]- + 3H2↑ (2分)
(2)c (2分)
(3)4Al (s)+ 3MnO2 (s) = 3Mn(s) +2Al2O3(s) ΔH=
本题解析:
本题难度:一般
5、选择题 下列说法中正确的是
A.离子化合物中可以含有共价键,但共价化合物中一定不含离子键
B.含有共价键的物质一定是共价化合物
C.H2O稳定是因为H2O中存在两个氢键
D.干冰升华时,分子内共价键会发生断裂
参考答案:A
本题解析:B项:只含有共价键的物质一定是共价化合物,故错;C项:H2O稳定是因为结构稳定,故错;D项:干冰升华,只是由固态变为了气态,共价键没有断裂,故错。故选A。
点评:本题考查的是化学键的相关知识,题目难度不大,注意基础知识的学习、掌握及应用。
本题难度:简单
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学知识点总结《炔烃的性质.. | ||