微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。以下关于PH3的叙述正确的是 (? )?
A.PH3分子中有未成键的孤对电子
B.PH3是非极性分子
C.它的分子构型是平面三角形
D.磷原子采用sp2杂化方式
参考答案:A
本题解析:PH3中P原子含有(5-1×3)÷2=1对孤对电子对数,A正确;B不正确,该化合物是极性分子;C不正确,该化合物是三角锥形结构;D不正确,应该是sp3杂化,答案选A。
点评:该题是中等难度的试题,试题基础性强,侧重能力的培养和解题方法的指导与训练。该题的关键是利用好价层电子对互斥理论准确判断出分子的空间结构,有助于培养学生的抽象思维能力。
本题难度:一般
2、选择题 主族元素W、X、Y、Z位于同一周期,原子序数依次增大,.Y、Z是非金属元素.W、X的最高价氧化物对应的水化物可以相互反应,W与Y可形成化合物W2Y,Y的最外层电子数是核外电子层数的2倍.下列说法正确的是( )
A.Y的气态氧化物比Z的气态氢化物稳定
B.W的最高价氧化物对应的水化物是已知最强的碱
C.Y单质和氧气、氢气都能发生化合反应,且产物都具有还原性
D.W、X、Y、Z四种元素的原子半径由小到大的顺序是:W<X<Y<Z
参考答案:W、X是金属元素,W、X的最高价氧化物对应的水化物应为碱,可以相互反应,说明一种为两性氧化物,应为Al(OH)3,则W为Na,X为Al,Y的最外层电子数是核外电子层数的2倍,且与Na、Al在同一周期,应为S元素,Z的原子序数最大,主族元素,只有Cl元素符合,则
A.非金属性Y<Z,Z的气态氢化物稳定,故A错误;
B.W为Na,对应的碱不是最小的碱,最强的碱应是金属性最强的金属,位于周期表左下角,为Cs,故B错误;
C.S单质和氧气、氢气都能发生化合反应,分别生成二氧化硫、硫化氢,二者具有还原性,故C正确;
D.同周期元素从左到右原子半径逐渐减小,应有W>X>Y>Z,故D错误.
故选C.
本题解析:
本题难度:简单
3、选择题 有A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,原子的第一电离能E﹤A, R是地壳中含量最高的金属元素,X原子核外的M层中有三对成对电子,Y为周期表前四周期中电负性最小的元素, Z原子核外电子数为24。
请回答下列问题:
(1)基态Z原子的核外电子排布式是?。AE2+与二氧化碳分子互为等电子体,AE2+的电子式是____。AX3分子的VSEPR模型是?。
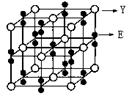
(2)某化合物由E、Y两种元素组成,其晶胞如图,该化合物的化学式为______。
(3)在化合物Y2ZE4的水溶液入适量硫酸,能观察到的现象是?。
(4)A的简单氢化物极易溶于E的简单氢化物,其原因是??。
(5)A的最高价氧化物对应水化物的稀溶液与R的单质反应时,A被还原到最低价,该反应的化学方程式是?。
参考答案:(1)1s22s22p63s23p63d54s1或[Ar])3d54s1(2分) (2分)四面体(1分)
(2分)四面体(1分)
(2)KO2(2分)
(3)溶液由黄色变成橙色?(2分)
(4)NH3、H2O都是极性分子,且它们分子间还能形成氢键(2分)
(5)8Al + 30HNO3 = 8Al(NO3)3 + 3NH4NO3 + 9H2O?(3分)
本题解析:根据题给信息知,A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,则A为氮元素;原子的第一电离能E﹤A,结合题给信息知E为氧元素; R是地壳中含量最高的金属元素,则R为铝元素;X原子核外的M层中有三对成对电子,则X为氯元素;Y为周期表前四周期中电负性最小的元素,则Y为钾元素; Z原子核外电子数为24,则铬元素。(1)Z为铬元素,基态铬原子的核外电子排布式是1s22s22p63s23p63d54s1或[Ar])3d54s1;NO2+与二氧化碳分子互为等电子体,根据二氧化碳的电子式写出NO2+的电子式是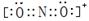 ;NCl3的中心价电子对数为4,分子的VSEPR模型是四面体;(2)某化合物由O、K两种元素组成,根据其晶胞结构利用切割法分析,1个晶胞中含有8个O,4个K,该化合物的化学式为KO2;(3)在化合物K2CrO4的水溶液入适量硫酸,发生的反应为2H++CrO42—===Cr2O72—+H2O,能观察到的现象是溶液由黄色变成橙色;(4)A的简单氢化物NH3极易溶于E的简单氢化物H2O,其原因是NH3、H2O都是极性分子,且它们分子间还能形成氢键;(5)A的最高价氧化物对应水化物HNO3的稀溶液与铝单质反应时,氮元素被还原到最低价,生成硝酸铝、硝酸铵和水,该反应的化学方程式是8Al + 30HNO3 = 8Al(NO3)3 + 3NH4NO3 + 9H2O。
;NCl3的中心价电子对数为4,分子的VSEPR模型是四面体;(2)某化合物由O、K两种元素组成,根据其晶胞结构利用切割法分析,1个晶胞中含有8个O,4个K,该化合物的化学式为KO2;(3)在化合物K2CrO4的水溶液入适量硫酸,发生的反应为2H++CrO42—===Cr2O72—+H2O,能观察到的现象是溶液由黄色变成橙色;(4)A的简单氢化物NH3极易溶于E的简单氢化物H2O,其原因是NH3、H2O都是极性分子,且它们分子间还能形成氢键;(5)A的最高价氧化物对应水化物HNO3的稀溶液与铝单质反应时,氮元素被还原到最低价,生成硝酸铝、硝酸铵和水,该反应的化学方程式是8Al + 30HNO3 = 8Al(NO3)3 + 3NH4NO3 + 9H2O。
本题难度:一般
4、简答题 某元素原子最外层上只有两个电子,该元素( )
A.一定是金属元素
B.一定是过渡元素
C.可能是金属元素也可能不是金属元素
D.一定是ⅡA族元素
参考答案:元素周期表中,最外层上只有两个电子的元素有He、ⅡA族元素、ⅡB族元素以及其它部分过渡元素,则
A.He元素原子最外层上只有两个电子,为非金属元素,故A错误;
B.He为零族元素,ⅡA族元素原子最外层上也只有两个电子,故B错误;
C.He为非金属元素,气体其它为金属元素,故C正确;
D.最外层上只有两个电子的元素有He、ⅡA族元素、ⅡB族元素以及其它部分过渡元素,故D错误.
故选C.
本题解析:
本题难度:一般
5、选择题 某主族元素R的原子其电子式可用下式表示: 。该元素组成的以下物质,其分子式肯定错误的是
。该元素组成的以下物质,其分子式肯定错误的是
[? ]
A.最高价氧化物分子式为R2O5
B.含氧酸分子式为 HRO3
C.含氧酸分子式为H3RO4
D.气态氢化物分子式为RH5
参考答案:D
本题解析:
本题难度:简单