微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 NA表示阿伏加德罗常数的值,下列说法正确的是
A.密封保存的46 g NO2气体含有的分子数为NA
B.0.1 mol/L 碳酸钠溶液中阴离子总数大于0.1 NA
C.标准状况下,22.4 L HF中含有的氟原子数目为NA
D.常温常压下,7.1 g Cl2与足量的Fe充分反应,转移的电子数目为0.2 NA
参考答案:D
本题解析:A在密闭容器中发生反应2NO2 N2O4.所以密封保存的46 g NO2气体含有的分子数少于NA。错误。B.z只给了浓度而无体积无法计算微粒数目的多少。错误。C.在标准状况下HF分子之间由于存在着氢键通常是以聚合分子的形式存在,所以,22.4 L HF中含有的氟原子数目大于NA。错误。D. 7.1 g Cl2的物质的量为0.1mol,每mol的氯气发生得到电子2mol,所以0.1mol的氯气与足量的Fe充分反应,转移的电子数目为0.2 NA。正确。
N2O4.所以密封保存的46 g NO2气体含有的分子数少于NA。错误。B.z只给了浓度而无体积无法计算微粒数目的多少。错误。C.在标准状况下HF分子之间由于存在着氢键通常是以聚合分子的形式存在,所以,22.4 L HF中含有的氟原子数目大于NA。错误。D. 7.1 g Cl2的物质的量为0.1mol,每mol的氯气发生得到电子2mol,所以0.1mol的氯气与足量的Fe充分反应,转移的电子数目为0.2 NA。正确。
本题难度:一般
2、填空题 (4分)10.4gR2SO4中含0. 1molR2+,则R2SO4的摩尔质量是?;R的相对原子质量是?。
参考答案:(4分)208g·mol-1(2分);? 56(2分)
本题解析:略
本题难度:一般
3、填空题 (9分)(1)明矾晶体可用来净水,它的化学式为 。
(2)反应KClO3+6HCl=KCl+3Cl2↑+3H2O 中氧化剂是 氧化剂和还原剂的物质的量之比:_______。
(3)加热10.0g碳酸钠和碳酸氢钠的混合物至质量不在变化,剩余固体的质量为8.45g,则混合物中碳酸钠的质量分数为 。 (填能或者不能)用澄清石灰水鉴别碳酸钠和碳酸氢钠溶液。
参考答案:(9分)(1)KAl(SO4)2·12H2O (1分)
(2)KClO3 (2分) 1:5 (2分) (3)42% (2分) 不能(2分)
本题解析:(1)明矾属于复盐,其化学式是KAl(SO4)2·12H2O。
(2)根据反应的方程式可知,氯酸钾中氯元素的化合价从+5价降低到0价,而氯化钾中氯元素的化合价从-1价升高到0价,所以氧化剂是氯酸钾,还原剂是氯化钾,二者的物质的量之比是1:5。
(3)碳酸氢钠受热分解的化学方程式是2NaHCO3 Na2CO3+H2O+CO2↑,根据题意可知,反应中固体质量减少1.55g,所以碳酸氢钠的质量是
Na2CO3+H2O+CO2↑,根据题意可知,反应中固体质量减少1.55g,所以碳酸氢钠的质量是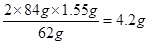 ,所以混合物中碳酸钠的质量分数为4.2÷10=42%。碳酸钠和碳酸氢钠都能和氢氧化钙反应生成白色沉淀碳酸钙,所以不能用澄清石灰水鉴别碳酸钠和碳酸氢钠溶液。
,所以混合物中碳酸钠的质量分数为4.2÷10=42%。碳酸钠和碳酸氢钠都能和氢氧化钙反应生成白色沉淀碳酸钙,所以不能用澄清石灰水鉴别碳酸钠和碳酸氢钠溶液。
考点:考查氧化还原反应的有关判断、依据碳酸氢钠分解的有关计算等
点评:如果是同一种元素的高价态和低价态之间发生氧化还原反应,则生成物的价态只能介于二者之间,且氧化产物的价态不能高于还原产物的价态,据此可以进行有关的判断。
本题难度:一般
4、计算题 在某石灰水中通入适量CO2最多能生成20 g沉淀。问:
(1)求通入CO2的物质的量?石灰水中含Ca(OH)2多少克?
(2)再通入多少克CO2可使上述沉淀恰好溶解?
参考答案:(1)0.2 mol;14.8 g
(2)8.8 g
本题解析:Ca(OH)2溶液中通入适量的CO2,Ca(OH)2全部转化为CaCO3沉淀。若在CaCO3中通入过量的CO2,CO2与CaCO3反应生成Ca(HCO3)2被溶解。
(1)设通入的CO2物质的量为x,石灰水中含Ca(OH)2质量为y。
Ca(OH)2+CO2 CaCO3↓+H2O
CaCO3↓+H2O
74 g? 1 mol? 100 g
y? x? 20 g
解得:x="0.2" mol?y="14.8" g
(2)设通入CO2质量为z,可使上述沉淀恰好溶解。
CaCO3+CO2+H2O Ca(HCO
Ca(HCO )
)
100 g? 44 g
20 g?z
z="8.8" g
解此类题要注意量的关系,量不同,生成物不同。生成沉淀“最多”,说明CO2适量,使Ca2+全部变为CaCO3沉淀。
本题难度:简单
5、计算题 尿素[CO(NH2)2]是一种高 效的肥料。在土壤中,尿素发生水角时缓慢释放出的氨气和二氧化碳都能被作物质吸收利用[CO(NH2)2+H2O===CO2+2NH3]。试回答:
效的肥料。在土壤中,尿素发生水角时缓慢释放出的氨气和二氧化碳都能被作物质吸收利用[CO(NH2)2+H2O===CO2+2NH3]。试回答:
⑴尿素中碳、氧、氮、氢元素的质量比为 。
⑵120g尿素完全水解,可产生二氧化碳的质量为 g,氨气的质量为 g。
参考答案:(1)3:4:7:1
(2)88 68
本题解析:略
本题难度:一般