微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 用质量分数为98%的浓硫酸配制100ml?3.0mol/L?稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积?②量取一定体积的浓硫酸?③溶解?④转移、洗涤?⑤定容?⑥摇匀
回答下列问题
(1)若所用浓硫酸密度为1.84g/cm3,则该浓硫酸的物质的量浓度为______,配制上述稀硫酸所需浓硫酸的体积是______(小数点后保留一位),量取浓硫酸所用的量筒的规格是______(从下列中选用A.10ml?B.20ml
C.50ml?D.100ml)
(2)第⑤步实验的操作是______
(3)为了保证实验的准确性,在第③和第④步操作之间还应该加多一步什么操作______,如果在配制溶液过程中出现下列情况对所配稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A.容量瓶用蒸馏水洗涤后残留有少量的水______
B.所用过的烧杯、玻璃棒未洗涤______
C.定容时仰视容量瓶刻度线______.
参考答案:(1)该浓硫酸的物质的量浓度为1000×1.84×98%98mol/L=18.4mol/L,根据稀释定律,稀释前后溶质的物质的量不变,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=100mL×3mol/L,解得:x≈16.3,故应选择20mL的量筒,
故答案为:18.4mol/L;16.3;B;
(2)定容操作为:向容量瓶内加蒸馏水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切为止,
故答案为:向容量瓶内加蒸馏水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切为止;
(3)浓硫酸稀释放出大量的热,向容量瓶内转移溶液应先冷却至室温,故答案为:冷却至室温;
A.最后需要定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响;
B.所用过的烧杯、玻璃棒未洗涤,少量溶质硫酸沾在烧杯壁与玻璃棒上,移入容量瓶内溶质硫酸的物质的量偏小,所配溶液的浓度偏小;
C.定容时,仰视容量瓶刻度线,液面在刻度线以上,导致所配溶液体积判断,所配溶液浓度偏大;
故答案为:无影响;偏小;偏小.
本题解析:
本题难度:一般
2、选择题 把500mL有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀.则原混合溶液中钾离子物质的量浓度为( )
A.0.1(b-2a)mol/L
B.10(2a-b)mol/L
C.10(b-a)mol/L
D.10(b-2a)mol/L
参考答案:取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀,则
Ba2++SO42-═BaSO4↓
1 1
amolamol
另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀,则
Ag++Cl-═AgCl↓
11
bmolbmol
由混合溶液分成5等份,则原溶液中钡离子的浓度为amol×50.5L=10amol/L,
氯离子的浓度为bmol×50.5L=10bmol/L,
根据溶液不显电性,设原混合溶液中钾离子物质的量浓度为x,
则10amol/L×2+x×1=10bmol/L×1,
解得x=10(b-2a)mol/L,
故选D.
本题解析:
本题难度:一般
3、选择题 已知NH3和HCl都是能用来做喷泉实验的气体。若在同温同压下用等体积的一个烧瓶收集满NH3,另一个收集HCl气体未满,喷泉实验停止后,两个烧瓶内溶液的关系是(不考虑溶质的扩散及静止时液面高度的影响)(? )
A.溶质的物质的量浓度相同、溶质的质量分数不同
B.溶质的质量分数相同、溶质的物质的量浓度不同
C.溶质的物质的量浓度和溶质的质量分数都不同
D.溶质的物质的量浓度和溶质的质量分数都相同
参考答案:A
本题解析:设该条件下气体摩尔体积为Vm,气体的体积为V,因气体极易溶于水,故溶液体积等于气体的体积。
c=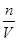 =
=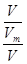 =
=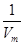 ,则不论NH3和HCl是否充满,物质的量浓度相同。因溶液中溶质质量和溶液质量不同,故溶质质量分数不同。
,则不论NH3和HCl是否充满,物质的量浓度相同。因溶液中溶质质量和溶液质量不同,故溶质质量分数不同。
本题难度:一般
4、选择题 设NA代表阿伏伽德罗常数的值,下列说法正确的是
A.标准状况下,22.4L水所含的分子数为NA
B.17g NH3中所含的原子个数为4NA
C.1L、1mol/L的稀盐酸中含有的氯化氢分子数为NA
D.在反应2H2O2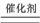 2 H2O+O2↑中每生成1mol O2转移的电子数为NA
2 H2O+O2↑中每生成1mol O2转移的电子数为NA