微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)CO2作为未来碳源,既可弥补因石油、天然气等大量消耗引起的“碳源危机”,又可有效地解决温室效应。请回答下列问题:
(1)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g) CO(g)+3H2(g) △H =" +206" kJ·mol-1。将等物质的量的CH4和H2O(g)充入2 L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内H2的平均反应速率为 。平衡后可以采取下列 的措施能使n(CO):n(CH4)增大。
CO(g)+3H2(g) △H =" +206" kJ·mol-1。将等物质的量的CH4和H2O(g)充入2 L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内H2的平均反应速率为 。平衡后可以采取下列 的措施能使n(CO):n(CH4)增大。
A.加热升高温度
B.恒温恒容下充入氦气
C.恒温下增大容器体积
D.恒温恒容下再充入等物质的量的CH4和H2O
(2)工业上可以利用CO为原料制取CH3OH。
已知:CO2(g)+3H2(g) CH3OH(g) +H2O(g) △H="-49.5" kJ·mol-1
CH3OH(g) +H2O(g) △H="-49.5" kJ·mol-1
CO2(g)+H2(g) CO(g)+H2O(g) △H=" +" 41.3 kJ·mol-1
CO(g)+H2O(g) △H=" +" 41.3 kJ·mol-1
①试写出由CO和H2制取甲醇的热化学方程式 。
②该反应的△S 0(填“>”或“<”或“=”),在 情况下有利于该反应自发进行。
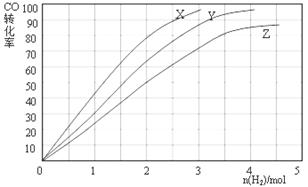
(3)某科研人员为研究H2和CO合成CH3OH的最佳起始组成比n(H2) : n(CO),在l L恒容密闭容器中通入H2与CO的混合气(CO的投入量均为1 mol),分别在230°C、250°C和270°C进行实验,测得结果如下图,则230℃时的实验结果所对应的曲线是 (填字母);理由是 。列式计算270℃时该反应的平衡常数K: 。
参考答案:(1)0.03mol/(L?min);AC;
(2)CO(g)+2H2(g)?CH3OH(l)△H=-90.8 kJ?mol-1; < 低温
(3)X
该反应是放热反应,温度越低转化率越高; K=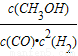 =
= =1.
=1.
本题解析:(1)5min内CO的平均化学反应速率v=△c/△t="0.1mol/(2L×5min)=" 0.01mol/(L?min), 氢气表示的平均反应速率是一氧化氮的3倍,即为0.03mol/(L?min);
根据反应CH4(g)+H2O(g)?CO(g)+3H2(g) △H =" +206" kJ·mol-1
A.加热升高温度,化学平衡正向移动,所以一氧化碳浓度增加,甲烷浓度减小,所以比值会增大,故A正确;
B.恒温恒容下充入氦气,各组分的浓度不变,所以平衡不移动,比值不变,故B错误;
C.恒温下增大容器体积则压强减小,化学平衡正向移动,所以一氧化碳浓度的减少量少于甲烷浓度减小量,所以比值会增大,故C正确;
D.恒温恒容下再充入等物质的量的CH4和H2O,相当于增大压强,化学平衡逆向动,所以一氧化碳浓度增加量少于甲烷浓度增加量,所以比值会减小,故D错误;
(2)①已知:①CO2(g) +3H2(g)  CH3OH(g) +H2O(g) △H="-49.5" kJ·mol-1
CH3OH(g) +H2O(g) △H="-49.5" kJ·mol-1
②CO2(g)+H2(g) CO(g)+H2O(g) △H=" +" 41.3 kJ·mol-1
CO(g)+H2O(g) △H=" +" 41.3 kJ·mol-1
CO和H2制取甲醇的热化学方程式可以经过①-②得到,所以该反应的焓变
△H=(-49.5kJ?mol-1)-(+41.3kJ?mol-1)=-90.8kJ?mol-1,
所以CO和H2制取甲醇的热化学方程式:CO(g)+2H2(g)?CH3OH(l) △H=-90.8 kJ?mol-1
②该反应气体分子数减少为熵减即△S<0,放热反应即△H<0,由△G=△H-T△S可得:低温下有利于反应的自发进行。
(3)合成甲醇是放热反应,温度越低CO转化率越大,结合图象可知,230℃的实验结果所对应的曲线是X;270℃时该反应的平衡常数K=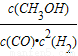 =
= =1
=1
考点:解化学反应速率的概念、反应速率的定量表示方法。 了解化学平衡常数的含义,能利用化学平衡常数进行相关计算。 理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识并能用相关理论解释其一般规律。了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。
点评:本题应掌握的知识点:
(1)化学反应速率v=△c/△t来计算反应速率,根据影响化学平衡移动的因素来回答判断;
(2)根据盖斯定律计算化学反应的焓变;由△G=△H-T△S判断反应自发性。
(3)依据反应是放热反应,温度越高,反应物转化率越小;根据K的表达式代入数据计算.
本题难度:困难
2、选择题 700℃时,向容积不变的1L密闭容器中充人一定量的CO和H2O,发生反应:
CO(g)+ H2O(g) CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t1<t2)
CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t1<t2)

下列说法不正确的是
A.O-t1 min的平均反应速率为v(H2)= 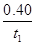 mol·L-l.min-1
mol·L-l.min-1
B.保持其他条件不变,若容器内的压强不改变时,该反应一定达到了化学平衡状态
C.保持其他条件不变,若起始时向容器中充入0.60mol CO和1.20mol H2O,则达到平衡时n(CO2)=0.40mol
D.保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO的转化率增大,CO2的浓度增大