微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 wg铁粉和铝粉的混合物,和过量的?NaOH反应,然后过滤,将沉淀完全收集后,放蒸发皿中加热,直至被加热的物质质量不再变化,取出蒸发皿中的物质称量仍为wg.求原混合物中铝粉的质量分数是( )
A.30%
B.50%
C.70%
D.90%
参考答案:wg铁粉和铝粉的混合物,和过量的NaOH反应,然后过滤,滤渣为Fe,
放入蒸发皿中完全灼烧后最终应生成Fe2O3,
取出蒸发皿中的物质称量仍为wg,
则铝粉的质量等于Fe2O3中O元素的质量,
则有原混合物中铝粉的质量分数为:3×163×16+2×56×100%=30%,
故选A.
本题解析:
本题难度:简单
2、选择题 某同学将一块铝箔用砂纸仔细打磨,除去表面的保护膜,用坩埚钳夹住放在酒精灯火焰上加热至熔化,发现熔化的铝并不滴落,而是好像有一层膜兜着。则下列说法错误的是( )?
A.兜着液体的这层膜是氧化铝
B.该实验说明了氧化铝的熔点高于铝的熔点
C.铝极易与空气中的氧气反应在表面形成氧化物保护膜
D.铝的化学性质较稳定,即使加热到熔化也不与空气中的氧气反应
参考答案:D
本题解析: 铝极易与氧气反应,在表面上形成氧化铝,其熔点高于铝的熔点,故加热时,熔化的铝不会滴落。
点评:金属及其化合物是重要的无机物,是历年高考的重点。考生在备考过程中应注意积累各物质的性质及重要的化学反应。
本题难度:简单
来源:91考试网 91Exam.org 3、选择题 (14分)金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下图所示:

其中,气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题:
(1)当Al与稀硝酸反应时,稀硝酸表现的性质是
A.只表现强氧化性?
B.只表现酸性
C.同时表现强氧化性及酸性
D.表现了强氧化性还表现了还原性
(2)在下列离子方程式的横线上填写产物的化学式(不需要配平)
Al + NO3-+ OH-+ H2O—→ +
(3)过量D的水溶液与A溶液反应的离子方程式是 ?
(4)D—→C反应的化学方程式是?
(5)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质是
(6)除去C中的E气体杂质可用的化学方法是:(用化学方程式表示)?
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是 ? 。
参考答案:(16分,每小题2分)
(1) C
(2) AlO2— + NH3
(3) 3NH3·H2O + Al3+ ="=" Al(OH)3↓+3 NH4+?
(4)? 4 NH3 +5O2 ="=" 4NO + 6 H2O
(5) N2
(6)? 3NO2 + H2O ="=" 2HNO3 + NO?
(7)? 1:1
本题解析:
金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,根据图示信息可知,在酸性环境下,反应生成铝盐和一氧化氮,碱性环境下生成偏铝酸盐和氨气,氨气催化氧化可以生成一氧化氮和水,一氧化氮可以和氧气反应生成二氧化氮,故A为硝酸铝,B为偏铝酸盐,C为NO,D为氨气,E为二氧化氮,F为硝酸.
(1)Al+4HNO3=Al(NO3)3+NO↑+2H2O,HNO3中的氮部分变价,同时表现强氧化性及酸性,选C;故答案为:C。
(2)由原子守恒和得失电子守恒得:碱性条件下铝以AlO2―形式存在,氨气催化氧化可以生成一氧化氮和水,故答案为: AlO2— + NH3
⑶过量的氨水不能溶解Al(OH)3, 3NH3·H2O + Al3+ ="=" Al(OH)3↓+3 NH4+发生反应生成氢氧化铝白色沉淀,故答案为: 3NH3·H2O + Al3+ ="=" Al(OH)3↓+3 NH4+
(4)D—→C反应的化学方程式:氨气催化氧化生成一氧化氮和水4 NH3 +5O2 ="=" 4NO + 6 H2O故答案为:4 NH3 +5O2 ="=" 4NO + 6 H2O
(5)6NO+4NH3=5N2+6H2O,8NH3+6NO2=5N2+12H2O,无毒氧化为N2, 故答案为: N2
⑹可以用水洗法,3NO2 + H2O ="=" 2HNO3 + NO,故答案为:3NO2 + H2O ="=" 2HNO3 + NO
⑺Al与NO3-在酸性条件下反应,金属铝被氧化为三价的铝离子,失去电子3mol,硝酸根被还原为一氧化氮,得到电子也是3mol,根据电子守恒,Al与被还原的NO3-的物质的量之比是1:1,故答案为:1:1.
本题难度:一般
4、计算题 (12分)碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·x?H2O]常用作塑料阻燃剂。
(1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和?。
(2)MgaAlb(OH)c(CO3)d·x?H2O中a、b、c、d的代数关系式为?。
(3)为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390g样品与足量稀盐酸充分反应,生成CO20.560L(已换算成标准状况下)。②另取一定量样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如右图所示(样品在2700C时已完全失去结晶水,6000C以上残留固体为金属氧化物的混合物)。
根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-): n(CO32-)(写出计算过程)。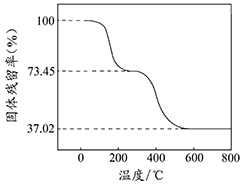
参考答案:
阻止燃烧
2a+3b=c+2d
(3)

本题解析:(1物受热分解为高熔点的氧化镁和氧化铝覆盖在可燃物表面,阻止燃烧;(2)物质中各元素的合价代数和为0,2a+3b=c+2d;(3)根据分解图像和已知信息,得出第一段是失去结晶水,第二段是分解为氧化物;应根据后一段计算OH-和CO32-的关系,加热时前者生成水,后者生成二氧化碳,二者的和可以根据图中的数据换算,再根据二氧化碳的质量计算出水的质量,进而得到OH-和CO32-的物质的量。
本题难度:一般
5、计算题 将镁粉和碳酸镁的混合物置于氧气中灼烧,直至质量不再改变为止。经测定,灼烧后所得固体质量与原混合物质量相同,求原混合物中镁粉和碳酸镁的质量比。
参考答案:11∶14
本题解析:整个题目全用文字叙述,没有一个可供直接利用的具体数据。仔细审视题意,抓住关键词语,将“灼烧后所得固体质量与原混合物质量相同”转化为(化隐含为显露)“Mg吸收的O2质量等于MgCO3分解放出的CO2质量”,即可由2Mg→O2和MgCO3→CO2,导出44Mg→16MgCO3。这一关系式表明,在原混合物中镁粉与碳酸镁的质量比是44×24∶16×84=11∶14。
本题难度:简单