微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 请在横线部分写出正确的化学方程式或离子方程式(每题2分,共12分)
(1)镁在二氧化碳中燃烧?。
(2)铝与碱溶液反应的离子方程式?。
(3)实验室制氢氧化铝的离子方程式?。
(4)铝与四氧化三铁高温反应?。
(5)氢氧化亚铁在空气中变质?。
(6)少量铁在氯气中燃烧? ?。
?。
参考答案:(1)2Mg+CO2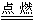 2MgO+C(2)2Al+2NaOH+2H2O==2NaAlO2+3H2
2MgO+C(2)2Al+2NaOH+2H2O==2NaAlO2+3H2
(3)Al3+ +3NH3.H2O=Al(OH)3↓+3NH4+(4)8AL+3Fe3O4==9Fe+4Al2O3(5)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(6)2Fe+3Cl2 2FeCl3;
2FeCl3;
本题解析:略
本题难度:简单
2、填空题 (已知锌与铝具有一定的相似性,如都能在强碱性溶液中形成酸根阴离子。实验室分析白铁(镀锌的铁)样品成分,称取1.00 g样品放在烧杯中,加入过量盐酸,然后用玻璃片盖住烧杯,首先观察到有大量气体冒出,后来放出气体速率变慢,至不再放出气体。接着加入过量的NaOH溶液,过滤分离出灰绿色沉淀,该沉淀在空气中加强热至质量不变,最后得到1.20 g红色粉末。
(1)白铁镀锌的作用是______________;盖玻璃片的作用是____________。
(2)放出气体速率由快变慢的原因是_______________________________________。
(3)为什么要加入过量NaOH溶液__________________________________________。
(4)样品中锌的质量分数是_______________________________________________。
参考答案:(1)在铁表面形成保护层,减缓铁的锈蚀?防止气泡逸出时使溶液溅出
(2)一开始是锌与酸反应,锌与铁构成原电池,后来仅是铁反应
(3)使铁元素转化成碱沉淀,而锌元素则以Zn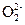 形式存在在溶液中
形式存在在溶液中
(4)16%
本题解析:锌在空气中可形成一层致密的氧化膜保护层,阻止里面铁的锈蚀。当金属与酸反应时,随着气泡的放出,会有少部分液体飞溅,加盖是为了不使溶液飞溅出烧杯,减小实验误差。当向反应后的溶液(含Zn2+、Fe2+)中加入过量NaOH溶液时,Zn2+转化为ZnO2-2而存在于溶液中,而沉淀是Fe(OH)2,但氢氧化亚铁不稳定,在空气中即被氧化成红褐色的氢氧化铁,强热后得到的1.20 g是Fe2O3,根据铁元素守恒,原金属混合物中含有铁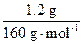 ×2×56 g·mol-1="0.84" g。
×2×56 g·mol-1="0.84" g。
本题难度:一般
3、选择题 将5.1g镁铝合金,投入到500mL2.0mol/L的盐酸中,金属完全溶解,再加入4.0mol/L的NaOH溶液,若要生成的沉淀最多,则NaOH溶液的体积是:?(?)
A.200mL
B.250ml
C.425mL
D.560mL
参考答案:B
本题解析:镁铝和盐酸反应,金属完全溶解,所以盐酸过量,全部转化为Mg2+、Al3+和H+。在溶液里和Cl-电荷守恒。在加入氢氧化钠,要是沉淀最多即所有的氯离子全部被OH-取代。故而有500*2.0=4.0V,V=250ml。
本题难度:一般
4、选择题 等体积、等物质的量浓度的盐酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5:6(相同状况),则甲、乙两烧杯中的反应情况可能分别是
A.甲、乙中都是铝过量
B.甲中铝过量,乙中碱过量
C.甲中酸过量,乙中铝过量
D.甲中酸过量,乙中碱过量
参考答案:B
本题解析:HCl、NaOH与Al发生反应的方程式为2Al+6HCl=2AlCl3+3H2↑;2Al+2NaOH+2H2O=2NaAlO2+3H2↑。由方程式可以看出等体积、等物质的量浓度的盐酸、氢氧化钠溶液若是与足量的Al发生反应放出的氢气体积比为1:3.。现在放出的气体的体积比为5:6>1:3,说明Al对于酸来说是过量的,对于NaOH来说是不足量的。因此选项为B。
本题难度:一般
5、填空题 (14分)已知硝酸与金属发生氧化还原反应的时候,一般硝酸浓度越稀,对应的还原产物中氮的化合价越低。现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示。则:
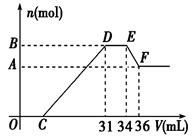
(1)试写出DE段、EF段所发生反应的离子方 程式:
程式:
DE段?
EF段?
(2)合金中铝的物质的量为?mol
(3)合金中金属的物质的量共为?mol
(4)求出C点的值为?ml
参考答案:(1)?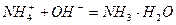 ?
?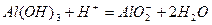 ?(各2分)
?(各2分)
(2)0.008mol(3分) ?(3)0.032mol(3分)?(4)7ml(4分)
本题解析:略
本题难度:简单