微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 由钠、镁、铝、锌四种金属单质中的两种组成的合金共12 g,跟足量的盐酸反应产生5.6 L氢气(标准状况),那么此合金中一定含有的金属是(?)
A.Na
B.Mg
C.Al
D.Zn
参考答案:D
本题解析:依题意,当产生H2 22.4 L即1 mol时,消耗合金的质量为48 g。产生1 mol H2,所消耗的Na、Mg、Al质量分别为46 g、24 g、18 g,均小于48 g。根据平均值原理,必有一种金属的摩尔质量大于48 g·mol-1。只有Zn符合要求。所以,该合金中必含有Zn。
本题难度:简单
2、选择题 既能与盐酸反应,又能与氢氧化钠溶液反应的物质是
A.AlCl3
B.NaAlO2
C.Al(OH)3
D.Na2CO3
参考答案:C
本题解析:略
本题难度:简单
3、选择题 近年科学家热衷于超原子的研究,美国《Science》上有论文宣布,发现了一种Al的超原子结构,这种超原子(Al13)是以1个Al原子在中心,12个Al原子在表面形成的三角二十面体结构。这种超原子具有40个价电子时最稳定。请预测稳定的Al13所带的电荷为()?
A.+3
B.+2
C.0
D.-1
参考答案:
D
本题解析:
该试题将中学化学知识与最新的科技成果相联系,中等难度,解答该试题时,重点抓住信息“这种超原子具有40个价电子时最稳定”,而铝的价电子为3,所以Al13为39,Al13要达到稳定结构,必然得到一个电子,显-1价,选D。
本题难度:一般
4、实验题 铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列三种不同实验方案进行探究。填写下列空白。
【探究一】实验方案:铝镁合金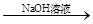 测定剩余固体质量,实验中发生反应的化学方程式是_________________________。
测定剩余固体质量,实验中发生反应的化学方程式是_________________________。
实验步骤:
(1)称取5.4 g铝镁合金粉末样品,投入V mL 2.0 mol·L-1 NaOH溶液中,充分反应。NaOH溶液的体积V≥______。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将______(填“偏高”或“偏低”)。
【探究二】实验方案:铝镁合金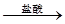 测定生成气体的体积实验装置:
测定生成气体的体积实验装置:
问题讨论:
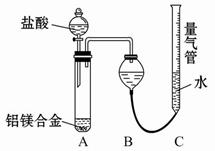
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置。你的意见是:_____(填“需要”或“不需要”)。
(2)为使测定结果尽可能精确,实验中应注意的问题是(写出两点):
①______________________________。
②______________________________。
【探究三】
实验方案:称量x g铝镁合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧。
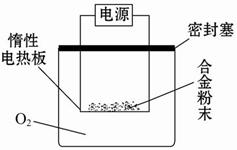
问题讨论:
(1)欲计算镁的质量分数,该实验中还需测定的数据是______。
(2)若用空气(不考虑CO2)代替O2进行实验,对测定结果有何影响? _____(填“偏高”、“偏低”或“无影响”)。
参考答案:
【探究一】2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(1)100? (2)偏高
【探究二】(1)不需要
(2)检查装置的气密性?合金完全溶解(或加入足量盐酸)?调整量气管C的高度,使C中液面与B液面相平?待冷却至室温再读数等(写出两点,答案合理即可)
【探究三】(1)灼烧后固体的质量? (2)偏高
本题解析:【探究一】镁铝合金中只有铝与氢氧化钠反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑,用极值法,假定5.4 g合金完全是铝时,根据方程式求出消耗氢氧化钠的体积为100 mL,故V≥100,若未洗涤固体,镁的表面附着其他杂质,质量偏大,测得镁的质量分数将偏高。
【探究二】(1)因为是排水量气,故不需要在A、B之间添加一个干燥、除酸雾的装置;(2)为使结果准确,应从以下几个方面考虑:检查装置的气密性;合金完全溶解(或加入足量盐酸);调整量气管C的高度,使C中液面与B中液面相平;待冷却至室温再读数等。
【探究三】称量x g铝镁合金粉末,要求镁的质量分数,还需要知道灼烧后固体的质量;若用空气代替O2进行实验,部分镁与氮气反应生成氮化镁,燃烧产物的质量减少,通过计算所得镁的质量偏高,测定结果偏高。
本题难度:一般
5、选择题 在天平两边各放一只盛有相同浓度、相同体积的足量盐酸溶液的烧杯,调节天平到平衡,在左边烧杯中放入3.6的铝粉,为使天平最终保持平衡,右边烧杯中应放入镁粉的量是?(?)
A.3.49g
B.3.60g
C.3.81g
D.3.92g
参考答案:A
本题解析:略
本题难度:简单