微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 铜及铜的化合物有多种应用.请回答下面相关问题:
(1)下列两种方法均可以制备CuSO4
①2Cu+O2
2CuO?CuO+H2SO4=CuSO4+H2O? ②Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
假如某工厂欲生产CuSO4,请选择一种方法并说明理由______.
(2)已知铜与稀硫酸不反应,但将铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示原因______.
如果铜片在稀硫酸中加热时滴入几滴H2O2,溶液也会很快呈蓝色,请用离子方程式表示原因______.
(3)已知:2Cu(s)+O2(g)=Cu2O(s);△H1=-12.0kJ/mol
2Cu(s)+S(s)=Cu2S(s);△H2=-79.5kJ/mol
S(s)+O2?(g)=SO2(g);△H3=-296.83kJ/mol
求?Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g);△H4=______kJ/mol
(4)某黑色固体据分析由Cu2S和CuS组成.
已知?Cu2S可以和硝酸反应,请配平下列化学反应方程式:□Cu2S+□HNO3□CuSO4+□Cu(NO3)2+□NO↑+□______
化学兴趣小组同学欲分析黑色固体的成分,设计了如下实验方案:先称取样品m1g,然后充分加热反应后测得生成CuO质量为m2g,则样品中含Cu2S______g.
2、填空题 从回收的含铜电缆废料中提取铜时,假若设计如下两种方案,回答有关问题。

(1)两个方案中,符合当前生产中绿色化学理念的是方案________,理由是__________。
(2)方案乙中铜溶解生成蓝色溶液时发生反应的离子方程式为____________________________,若不考虑绿色化学要求,溶解铜生成硫酸铜时,还可将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使铜溶解完全,则理论上硫酸和硝酸的物质的量之比最佳为:____________。
(3)为了提高原料的利用率,最后一步所得浅绿色滤液通过蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥可得到一种结晶水合物的晶体。获得晶体后对其进行检测:
①先取a?g的晶体进行脱水实验,获得无水固体为(a-1.26)g ?
②将无水固体溶于足量的水配成溶液后滴加1.00mol/L的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全。通过计算测知该晶体的化学式是___________________。
(4)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5%?。工业上用硫酸铜等原料常通过下列反应制备CuCl?:2CuSO4+?Na2SO3?+?2NaCl?+?Na2CO3?=?2CuCl?↓+?3Na2SO4?+?CO2↑ 测定CuCl质量分数时先准确称取所制备的0.2500g?CuCl样品置于一定量的0.5mol/L?FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol/L?Ce(SO4)2溶液滴定到终点,消耗24.60mL?Ce(SO4)2溶液。有关反应的离子方程式为:Fe3++CuCl=Fe2++Cu2++Cl-?,Ce4+?+?Fe2+?=?Fe3+?+?Ce3+ ?
通过计算说明上述样品中CuCl的质量分数是否符合标准。
3、简答题 废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
(1)写出工业上制备印刷电路板原理的离子方程式:______
(2)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是______(填字母).
A.热裂解形成燃油?B.露天焚烧
C.作为有机复合建筑材料的原料?D.直接填埋
(3)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.
写出在H2SO4溶液中Cu与H2O2?反应生成Cu2+?和H2O的离子方程式______.
(4)控制其他条件相同,印刷电路板的金属粉末用10%?H2O2和3.0mol?L-1?H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80
铜平均溶解速率?(×10-3?mol?L-1?min-1)
7.34
8.01
9.25
7.98
7.24
6.73
5.76
|
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______.
(5)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是______.
4、填空题 氧化还原反应在工农业生产和日常生活中有广泛运用
(1)人通过呼吸作用吸入氧气,氧化体内的葡萄糖(C6H12O6)提供能量以维持生命活动,反应为:
C6H12O6+6O2→6CO2+6H2O+能量,该反应中的还原剂是______________。
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有____________。(填“氧化性”或“还原性”)
(3)铁是生物体中不可缺少的微量元素,铁在人体中是以Fe2+和Fe3+的形式存在的,而 Fe2+更容易被吸收。服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中维生素C所起的作用是_________。(填“氧化作用”或“还原作用”)
(4)缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式,而硫酸铁则无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是_____________。
(5)Fe3+在工业上有重要用途。例如印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作“腐蚀剂”刻制印刷电路,生成CuCl2和FeCl2,写出离子方程式____________________。
5、填空题 铜和硝酸反应的物质的量的关系如图所示,纵坐标表示消耗铜的物质的量,横坐标表示消耗硝酸的物质的量,坐标图中各条线表示下列反应:
A、铜和浓硝酸 B、铜和稀硝酸 C、铜和被还原的浓硝酸D、铜和被还原的稀硝酸
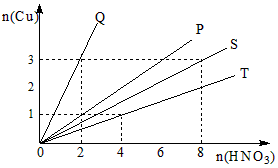
(1)Q表示反应___________;
(2)P表示反应___________;
(3)S表示反应___________;
(4)T表示反应___________。