微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 铜及铜的化合物有多种应用.请回答下面相关问题:
(1)下列两种方法均可以制备CuSO4
①2Cu+O2
2CuO?CuO+H2SO4=CuSO4+H2O? ②Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
假如某工厂欲生产CuSO4,请选择一种方法并说明理由______.
(2)已知铜与稀硫酸不反应,但将铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示原因______.
如果铜片在稀硫酸中加热时滴入几滴H2O2,溶液也会很快呈蓝色,请用离子方程式表示原因______.
(3)已知:2Cu(s)+O2(g)=Cu2O(s);△H1=-12.0kJ/mol
2Cu(s)+S(s)=Cu2S(s);△H2=-79.5kJ/mol
S(s)+O2?(g)=SO2(g);△H3=-296.83kJ/mol
求?Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g);△H4=______kJ/mol
(4)某黑色固体据分析由Cu2S和CuS组成.
已知?Cu2S可以和硝酸反应,请配平下列化学反应方程式:□Cu2S+□HNO3□CuSO4+□Cu(NO3)2+□NO↑+□______
化学兴趣小组同学欲分析黑色固体的成分,设计了如下实验方案:先称取样品m1g,然后充分加热反应后测得生成CuO质量为m2g,则样品中含Cu2S______g.
参考答案:(1)方法①中Cu、H2SO4的利用率100%,且无污染,方法②中Cu的利用率100%,H2SO4的利用率50%,且产生污染物,故答案:选择方法①原料利用率高,污染少;
(2)因溶液中有氧气,加热能与铜反应生成氧化铜:2Cu+O2?加热?.?2CuO,氧化铜再与硫酸反应:CuO+H2SO4=CuSO4+H2O,两式相加:2Cu+O2+2H2SO4?△?.?2CuSO4+2H2O,因加热时滴入几滴
H2O2,溶液也会很快呈蓝色,说明H2O2能讲铜氧化成铜离子,离子反应为Cu+H2O2+2H+?△?.?Cu2++2H2O,故答案:2Cu+O2+2H2SO4?△?.?2CuSO4+2H2O;Cu+H2O2+2H+?△?.?Cu2++2H2O;?
(3)已知:2Cu(s)+12O2(g)=Cu2O(s);△H1=-12.0kJ/mol? ①
? 2Cu(s)+S(s)=Cu2S(s);△H2=-79.5kJ/mol? ②
? S(s)+O2?(g)=SO2(g);△H3=-296.83kJ/mol? ③
根据盖斯定律③-①×2-②可得Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g);△H4=-193.33kJ/mol,
故答案为:-193.33;
(4)根据化合价升降总数相等可知,
? Cu2S? Cu:+1→+2↑2? 共↑10×3
? ?S:-2→+6↑8?
? ?HNO3 N:+5→+2↓3×10?
则配平后的化学反应为3Cu2S+16HNO3?△?.?3CuSO4+3Cu(NO3)2+10NO↑+8H2O,
故答案:3,16,3,3,10,8H2O;
(5)设Cu2S?的质量为x,CuS?的质量为y,
?Cu2S~2CuO? ?CuS~CuO
? 160? 160? 96? 80
? ?x? x? y? 56?y?
建立方程组:
本题解析:
本题难度:一般
2、填空题 从回收的含铜电缆废料中提取铜时,假若设计如下两种方案,回答有关问题。

(1)两个方案中,符合当前生产中绿色化学理念的是方案________,理由是__________。
(2)方案乙中铜溶解生成蓝色溶液时发生反应的离子方程式为____________________________,若不考虑绿色化学要求,溶解铜生成硫酸铜时,还可将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使铜溶解完全,则理论上硫酸和硝酸的物质的量之比最佳为:____________。
(3)为了提高原料的利用率,最后一步所得浅绿色滤液通过蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥可得到一种结晶水合物的晶体。获得晶体后对其进行检测:
①先取a?g的晶体进行脱水实验,获得无水固体为(a-1.26)g ?
②将无水固体溶于足量的水配成溶液后滴加1.00mol/L的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全。通过计算测知该晶体的化学式是___________________。
(4)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5%?。工业上用硫酸铜等原料常通过下列反应制备CuCl?:2CuSO4+?Na2SO3?+?2NaCl?+?Na2CO3?=?2CuCl?↓+?3Na2SO4?+?CO2↑ 测定CuCl质量分数时先准确称取所制备的0.2500g?CuCl样品置于一定量的0.5mol/L?FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol/L?Ce(SO4)2溶液滴定到终点,消耗24.60mL?Ce(SO4)2溶液。有关反应的离子方程式为:Fe3++CuCl=Fe2++Cu2++Cl-?,Ce4+?+?Fe2+?=?Fe3+?+?Ce3+ ?
通过计算说明上述样品中CuCl的质量分数是否符合标准。
参考答案:(1)乙;甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾
(2)2Cu + O2 +4H+==2Cu2+ + 2H2O
(3)FeSO4·7H2O
(4 )97.9% (合格)
本题解析:
本题难度:一般
3、简答题 废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
(1)写出工业上制备印刷电路板原理的离子方程式:______
(2)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是______(填字母).
A.热裂解形成燃油?B.露天焚烧
C.作为有机复合建筑材料的原料?D.直接填埋
(3)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.
写出在H2SO4溶液中Cu与H2O2?反应生成Cu2+?和H2O的离子方程式______.
(4)控制其他条件相同,印刷电路板的金属粉末用10%?H2O2和3.0mol?L-1?H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80
铜平均溶解速率?(×10-3?mol?L-1?min-1)
7.34
8.01
9.25
7.98
7.24
6.73
5.76
|
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______.
(5)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是______.
参考答案:(1)金属铜可以和氧化性的三价铁之间发生氧化还原反应,其离子方程式为:Cu+2Fe3+=Cu2++2Fe2+,故答案为:Cu+2Fe3+=Cu2++2Fe2+;
(2)露天焚烧会产生污染环境的气体,直接填埋时会引起水体和土壤的污染,故选:BD;
(3)金属铜在酸性环境下和双氧水的反应为:Cu+H2O2+2H+=Cu2++2H2O,故答案为:Cu+H2O2+2H+=Cu2++2H2O;
(4)根据测得不同温度下铜的平均溶解速率的数据,会发现随着温度的升高,铜的平均溶解速率,当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,因为双氧水受热易分解,导致金属铜的反应速率减慢,故答案为:H2O2分解速率加快;
(5)根据题干信息,可知发生的反应为2Cu2++SO32-+2Cl-H2O?△?.?2CuCl↓+SO42-+2H+,故答案为:2Cu2++SO32-+2Cl-+H2O?△?.?2CuCl↓+SO42-+2H+.
本题解析:
本题难度:一般
4、填空题 氧化还原反应在工农业生产和日常生活中有广泛运用
(1)人通过呼吸作用吸入氧气,氧化体内的葡萄糖(C6H12O6)提供能量以维持生命活动,反应为:
C6H12O6+6O2→6CO2+6H2O+能量,该反应中的还原剂是______________。
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有____________。(填“氧化性”或“还原性”)
(3)铁是生物体中不可缺少的微量元素,铁在人体中是以Fe2+和Fe3+的形式存在的,而 Fe2+更容易被吸收。服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中维生素C所起的作用是_________。(填“氧化作用”或“还原作用”)
(4)缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式,而硫酸铁则无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是_____________。
(5)Fe3+在工业上有重要用途。例如印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作“腐蚀剂”刻制印刷电路,生成CuCl2和FeCl2,写出离子方程式____________________。
参考答案:(1)C6H12O6
(2)还原性
(3)还原作用
(4)保护FeSO4不被空气中的氧气氧化
(5)2Fe3++Cu==2Fe2++Cu2+
本题解析:
本题难度:一般
5、填空题 铜和硝酸反应的物质的量的关系如图所示,纵坐标表示消耗铜的物质的量,横坐标表示消耗硝酸的物质的量,坐标图中各条线表示下列反应:
A、铜和浓硝酸 B、铜和稀硝酸 C、铜和被还原的浓硝酸D、铜和被还原的稀硝酸
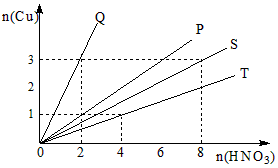
(1)Q表示反应___________;
(2)P表示反应___________;
(3)S表示反应___________;
(4)T表示反应___________。
参考答案:(1)D
(2)C
(3)B
(4)A
本题解析:
本题难度:一般