微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在钢铁腐蚀过程中,下列五种变化可能发生的是( )
①Fe由+2价转为+3价?
②O2被还原、
③产生H2、
④Fe(OH)3失水形成Fe2O3-xH2O、
⑤杂质碳被氧化.
A.①②③④
B.只②③④
C.只①②
D.①②③④⑤
参考答案:钢铁生锈的过程是金属铁发生了吸氧腐蚀(或是析氢腐蚀)的原电池原理,铁为负极,发生失电子的氧化反应,Fe-2e-=Fe2+,正极上是氧气得电子发生还原反应,2H2O+O2+4e-=4OH-,O2被还原,或是在酸性环境下,氢离子得电子的过程,会产生氢气,氢氧化亚铁易被氧气氧化为氢氧化铁,4Fe(OH)2+O2+2H2O=4Fe(OH)3,Fe由+2价转为+3价,最后Fe(OH)3失水形成Fe2O3?xH2O,即为铁锈的成分.
故选A.
本题解析:
本题难度:一般
2、选择题 下列条件下钢铁不易被腐蚀的是:
A.电解食盐水铁做阴极
B.酸雨
C.镀锡铁镀层被破坏
D.潮湿空气
参考答案:A
本题解析:A、用电解原理保护金属时,金属应作电解池阴极,阴极上带负电荷,易发生还原反应,保铁不被腐蚀;B、酸雨呈酸性,铁、杂质和雨水能构成原电池,铁作原电池负极而容易被腐蚀,另外H+离子浓度高,加快腐蚀速率;C、铁的还原性强,Fe―2e―=Fe2+腐蚀更快;D、提供原电池反应的发生所需条件,加快腐蚀速率。选A。
考点?:金属防腐
本题难度:一般
3、填空题 (1)用食用油炒咸菜的铁锅如果没有洗净,不久会出现红褐色锈斑。则铁锅的锈蚀属于?腐蚀(填“析氢”或“吸氧”);该腐蚀正极的电极反应式为?;
此反应每转移2mol电子消耗的O2在标准状况下的体积为?L。
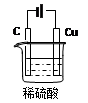
(2)某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4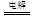 CuSO4+H2↑请在右边方框中画出能够实验这一反应的装置图(作必要的标注);某同学做该实验时,看到碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是???。
CuSO4+H2↑请在右边方框中画出能够实验这一反应的装置图(作必要的标注);某同学做该实验时,看到碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是???。
参考答案:(1)吸氧? 2H2O+O2+4e-=4OH-? 11.2L
(2)如右图(图正确1分,标注1分)
两极与电源的正负极接反了(或铜棒接电源的负极等)
本题解析:(1)红褐色锈斑的主要成分是Fe(OH)3,其主要是由于铁发生吸氧腐蚀时产生的。其发生的过程为:①正极反应:2H2O+O2+4e-=4OH-,负极反应:Fe-2e-=Fe2+;②4Fe(OH)2+2H2O+O2=4Fe(OH)3。由正极反 应式可知,当转移2mol电子时,消耗的氧气的量为0.5mol,因此在标准状态下的体积为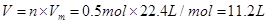 。
。
(2)由题可知,实现这一反应的装置应为电解池装置,且铜做为阳极。因此该装置图如下:
“某同学做该实验时,看到碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀”铜棒没被腐蚀,说明此时铜棒应作为了阴极。
点评:本题综合考查了“原电池”与“电解池”等内容,属于基础题,也是高考的重要考点。本题的难点在于第二问对装置的判断。对于此种题型,应充分利用化学方程式,判断反应进行的难易以及氧化反应、还原反应,即可得出结论。
本题难度:一般
4、填空题 用图所示的装置进行电解。通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色。
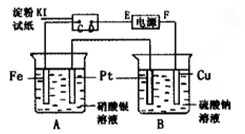
(1)E为电源的?极(填“正”或“负”);
(2)A中发生反应的化学方程式为?;
(3)在B中观察到的现象是?;
(4)室温下,若从电解开始到结束,A、B装置中共 收集到气体0.168 L(标况),若电解过程中无其他副反应发生,经测定电解后A中溶液体积恰为1000mL,求A溶液的pH。
收集到气体0.168 L(标况),若电解过程中无其他副反应发生,经测定电解后A中溶液体积恰为1000mL,求A溶液的pH。
参考答案:略
本题解析:略
本题难度:一般
5、填空题 某研究小组对铁生锈进行研究.
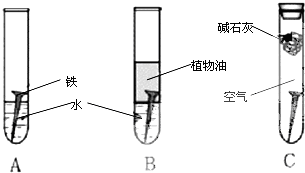
(1)经过较长时间后,甲同学观察到的现象是:上述图中的铁钉最容易生锈的是______
(2)在铁钉的锈蚀过程中,Fe发生了______(填“氧化”或“还原”)反应
(3)铁生锈的外部条件是______
(4)若为了防止铁钉生锈,该同学想在铁钉表面镀上一层金属,该金属最好是______
A.锡?B.铜?C.锌.
参考答案:(1)A、铁在潮湿的空气中易发生电化学腐蚀;B、植物油隔绝空气,铁难以腐蚀,;C、碱石灰吸水,在干燥的空气中铁难以腐蚀,故答案为:A;
(2)铁为活泼金属,易失去电子而被氧化,故答案为:氧化;
(3)铁在潮湿的空气中易形成原电池反应,发生吸氧腐蚀而被氧化,故答案为:潮湿的空气;
(4)在铁表面镀上一层锌,锌比铁活泼,当镀层破损后,易腐蚀锌而保护铁,故答案为:C.
本题解析:
本题难度:一般