微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 根据钫(Fr)在周期表中的位置预言其性质,其中不正确的是(? )
A.在空气中燃烧时生成氧化物Fr2O
B.在已知元素中具有最大的原子半径
C.氧化物对应的水化物是极强的碱
D.其单质的熔点比金属钠的熔点低
参考答案:A
本题解析:钫属于第7周期第IA,同主族元素自上而下原子半径逐渐增大,金属性逐渐增强,所以钫的燃烧产物不是Fr2O,即选项A是错误的,碱金属单质随核电荷数的递增熔点逐渐降低。答案选A。
本题难度:一般
2、填空题 下表是元素周期表的一部分,回答下列问题:
周期
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0
|
2
| ?
| ?
| ?
| ①
| ②
| ③
| ④
| ?
|
3
| ⑤
| ⑥
| ⑦
| ⑧
| ⑨
| ⑩
| 
| 
|
(1)写出③、⑤两种元素形成的化合物有两种,化学式是:?,?。
(2)上面主族元素中原子半径最大的是?,非金属性最强的是?。
(3)这些元素的最高价氧化物的水化物中,酸性最强的是___________(填化学式,下同);碱性最强的是________;能形成两性氢氧化物的元素是________。
参考答案:(7分)(1)Na2O、Na2O2(2分)
(2)⑤;④(或填Na;F)(2分) ?(3)HClO4;NaOH;Al(3分)
本题解析:根据元素在周期表中的相对位置可知,①~?分别是C、N、O、F、Na、Mg、Al、Si、P、S、Cl、Ar。
(1)钠和氧两种元素形成的化合物有氧化钠和过氧化钠,化学式分别是Na2O、Na2O2。
(2)同周期自左向右原子半径逐渐减小,非金属性逐渐增强。同主族自上而下原子半径逐渐增大,非金属性逐渐减弱,所以上面主族元素中原子半径最大的是Na,非金属性最强的是F。
(3)非金属性或金属性越强,则最高价氧化物的水化物的酸性或碱性越强,所以这些元素的最高价氧化物的水化物中,酸性最强的是HClO4,碱性最强的是NaOH ,能形成两性氢氧化物的元素是Al。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
3、选择题 根据元素的原子序数,不能确定的是
A.原子核内质子数
B.原子核内中子数
C.原子核外电子数
D.元素种类
参考答案:B
本题解析:原子序数等于质子数,等于核外电子数。中子数是由质量数和质子数共同决定的,所以答案选B。
本题难度:简单
4、选择题 稀土是工业味精,邓小平说过“中东有石油,我们有稀土”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是(?)
A.已知Ce原子序数是58,则其为镧系元素
B.铈有四种稳定的核素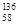 Ce、
Ce、 Ce、
Ce、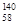 Ce、
Ce、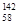 Ce,它们互为同位素
Ce,它们互为同位素
C.用Ce(SO4)2溶液可与硫酸亚铁溶液反应,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+
D.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑
参考答案:AB
本题解析:A.镧系元素是第57号元素镧到71号元素镥15种元素的统称;B.质子数相同而中子数不同的一类原子互称为镧系元素;C.电荷不守恒;D.由可Fe3+氧化I-可知,Ce4+也可氧化I-,故CeI4不存在,应为CeI3.
本题难度:一般
5、选择题 日本核事故释放出的极微量人工放射性核素131I,它能引发甲状腺癌;但127I却是人体必需的。127I可阻隔甲状腺吸收放射性131I。碘盐含127I为 30 mg·kg-1,成人一次摄入碘盐约3 kg才有预防效果。下列有关说法不正确的是(?)
A.131I与127I互为同位素
B.相同物质的量的131I与127I的质子数不同
C.131I与127I 是两种不同核素
D.日用碘盐对预防碘辐射起不到有效作用
参考答案:B
本题解析:相同物质的量的131I与127I的质子数相同,中子数不同。131I与127I 是两种不同核素?,互为同位素,日用碘盐对预防碘辐射起不到有效作用。
本题难度:一般