微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 实验室配制500mL?0.5mol?L-1的NaCl溶液,有如下操作步骤:
1把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解;
2把①所得溶液小心转人500mL容量瓶中;
3继续向容量瓶中加蒸馏水至液面距离刻度l~2cm处,改用胶头滴管小心滴加蒸
馏水至溶液凹液面底部与刻度线相切
4用少量蒸馏水洗涤烧杯和玻璃棒2-3次,每次洗涤的液体都小心转入容量瓶,
并轻轻摇匀;
5将容量瓶塞紧,充分摇匀.
请填写下列空白:
A.本实验所用氯化钠的质量为?
B.实验操作步骤的正确顺序为(填序号)?
C.若出现如下情况,对所配溶液浓度将有何影响?(填偏高,偏低,无影响)
没有进行操作④?;加蒸馏水时不慎超过了刻度线后吸出少许溶液?.向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面?.为加速固体溶解,可稍微加热并不断搅拌.在未降至室温时,立即将溶液转移至容量瓶定容?.定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度?.定容时仰视?.
参考答案:
本题解析:
本题难度:一般
2、填空题 实验室需要配置480mL?1mol?L-1的硫酸溶液,其实验步骤为
①计算所需浓硫酸的体积;
②将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶中,轻轻的振荡;
③量取浓硫酸
④继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面最低点与刻度线相切
⑤用适量的蒸馏水稀释浓硫酸,冷却至室温;
⑥盖好瓶塞,摇匀;
根据上述信息回答问题:
(1)本实验操作步骤的正确顺序为______
(2)若采用质量分数为98%(密度为1.84g?cm-3)的浓硫酸配制则需取用______mL(保留小数点后一位)
(3)实验中用到的仪器除了量筒、烧杯、胶头滴管以外,还需要哪些仪器才能完成该实验______
(4)写出⑤中稀释硫酸的操作过程______.
(5)如果实验遇到下列情况,对该硫酸物质的量浓度有何影响(填“偏高”、“偏低”或者“不变”)
①硫酸稀释后没有冷却至室温就转移至容量瓶并定容______
②搅拌时不小心洒出一小滴溶液______
③定容时俯视观察液面______
④定容、摇匀后发现凹液面最低点低于刻度线______.
参考答案:(1)操作步骤有计算、量取、稀释、冷却、移液、洗涤移液、定容、摇匀等操作,所以其操作顺序是:①③⑤②④⑥,
故答案为:①③⑤②④⑥;
(2)C=103ρWMmol/L=103×1.84×98%98mol/L=18.4mol/L,
设所需浓硫酸的体积为V,则有V×18.4mol/L=O.5L×1mol/L,v=0.0272L=27.2 mL,故答案为:27.2;
(3)由提供的仪器可知还缺少起搅拌和引流作用的玻璃棒、配制溶液的500ml容量瓶,故答案为:玻璃棒,500mL容量瓶;
(4)稀释浓硫酸时,要将浓硫酸沿着烧杯壁慢慢的注入水里,并不断搅拌,防止局部温度过高而溅出液体,
故答案为:将浓硫酸沿着烧怀壁慢慢的注入水里,并不断搅拌;
(5)①硫酸稀释后没有冷却至室温就转移至容量瓶并定容,溶液冷却后溶液体积偏小,配制溶液浓度偏高,故答案为:偏高;
②搅拌时不小心洒出一小滴溶液,导移入容量瓶内溶质硫酸的物质的量偏小,所配溶液浓度偏低,故答案为:偏低;
③定容时俯视观察液面,凹液面在刻度线下方,导致溶液体积偏小,配制溶液浓度偏高,故答案为:偏高;
④定容、摇匀后发现凹液面最低点低于刻度线,少量溶液残留在瓶口与瓶塞之间,对于溶质的物质的量和溶液的体积都无影响,所以配制溶液浓度不变,故答案为:不变.
本题解析:
本题难度:简单
3、填空题 实验室制配0.40mol/L的NaCl溶液80mL,有以下仪器:
①烧杯?②100mL量筒?③100mL容量瓶?④500mL容量瓶?⑤玻璃棒?⑥托盘天平(带砝码)?⑦药匙
(1)配制该溶液应选用______mL容量瓶;
(2)向容量瓶中加入蒸馏水,到液面______时,改用______加蒸馏水至液面最低点与刻度线相切,最后______(填所选字母:A.左右旋转?B.上下颠倒)摇匀.
(3)取80ml配制好的溶液,加水稀释到200ml,这浓度变为______.
(4)配制一定物质的量浓度的溶液,造成浓度偏高的操作是______
A.定容时,滴加蒸馏水超过刻度线
B.未洗涤烧杯和玻璃棒
C.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
D.定容时,眼睛俯视刻度线.
参考答案:(1)实验室没有80mL的容量瓶,应选择大于80mL且容积相近规格的容量瓶,故选择100mL容量瓶,
故答案为:100;
(2)当加水至液面距离刻度线1~2cm时,改用胶头滴管加蒸馏水至液面最低点与刻度线相切,最后盖好瓶塞,上下颠倒,反复摇匀,
故答案为:离刻度线1-2cm;胶头滴管;B;
(3)根据稀释定律,稀释前后溶质的物质的量不变,故稀释后溶液的浓度=80mL×0.4mol/L200mL=0.16mol/L,
故答案为:0.16mol/L;
(4)A.定容时,滴加蒸馏水超过刻度线,溶液的体积偏大,所配溶液浓度偏低,故A不符合;
B.未洗涤烧杯和玻璃棒,少量氯化钠沾在烧杯壁与玻璃棒上,移入容量瓶内氯化钠的物质的量偏小,所配溶液浓度偏低,故B不符合;
C.洗涤烧杯和玻璃棒的溶液未转入容量瓶中,移入容量瓶内氯化钠的物质的量偏小,所配溶液浓度偏低,故C不符合;
D.定容时,眼睛俯视刻度线,液面在刻度线上方,溶液体积偏小,所配溶液浓度偏该,故D符合;
故答案为:D.
本题解析:
本题难度:一般
4、填空题 (1)写出图1中序号①~④仪器的名称:
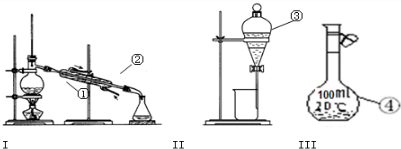
①______②______③______④______
(2)仪器①~④中,使用时必须检查是否漏水的有______.(填仪器序号)
(3)分离碘水中的碘应先选择装置______(填装置序号)进行操作A,再选装置进行______操作(填操作名称).进行操作A时,需在碘水中加一试剂,在选择试剂时,下列性质你认为哪些性质是必需的:______(填序号).
①常温下为液态②I2在其中溶解程度大③与水互溶程度小④密度要比水大
(4)图2是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制480mL1mol/L的稀硫酸.
可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.
请回答下列问题:
a.配制稀硫酸时,还缺少的仪器有______、______(写仪器名称);
b.经计算,配制480mL1mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为______mL,量取硫酸时应选用______mL规格的量筒;
A.10mLB.50mLC.100mLD.200mL
c.对所配制的稀硫酸进行测定,发现其浓度大于1mol/L,配制过程中下列各项操作可能引起该误差的原因有______.
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.定容时,俯视容量瓶刻度线进行定容
C.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作
D.转移溶液时,不慎有少量溶液洒到容量瓶外面
E.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处.
参考答案:(1)由图中仪器的结构可知,①为蒸馏烧瓶、②是冷凝管、③是分液漏斗、④是100mL容量瓶,
故答案为:蒸馏烧瓶;冷凝管;分液漏斗;100mL容量瓶;
(2)因分液漏斗和100mL容量瓶在使用前要检查是否漏水,蒸馏烧瓶、冷凝管不需要检查是否漏水,
故答案为:③④;
(3)碘在四氯化碳中的溶解度较在水中大,并且四氯化碳和水互不相溶,可用萃取的方法分离,接着可用分液方法将两层液体分开,故分离碘水中的碘应选择装置II;
四氯化碳易挥发,可用蒸馏的方法分馏得到四氯化碳,分离碘与四氯化碳;
碘在萃取剂中的溶解度大于在水中的溶解度,萃取剂和水不互溶,且萃取剂和碘不反应,故选②③,
故答案为:II;蒸馏;②③;
(4)a、没有480mL容量瓶,选择500mL容量瓶.
操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
由提供的仪器可知还需要仪器有:500mL容量瓶、玻璃棒;
故答案为:500mL容量瓶、玻璃棒;
b、浓H2SO4的物质的量浓度c=1000×1.84×98%98mol/L=18.4mol/L.根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,
所以xmL×18.4mol/L=500mL×1mol/L,解得:x≈27.2,
所需浓硫酸的体积为27.2mL.量筒规格越接近所需浓硫酸体积误差越小,所以选择50mL量筒,
故答案为:27.2;B;
c、A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸,量取浓硫酸的体积增大,所配溶液浓度偏高,故A符合;
B.定容时,俯视容量瓶刻度线,液面在刻度线以下,导致所配溶液体积减小,所配溶液浓度偏高,故B符合;
C.溶液有热胀冷缩的性质,浓硫酸稀释,放出大量的热,溶解后未恢复室温立即转移到容量瓶中定容,导致所配溶液体积减小,所配溶液浓度偏高,故C符合;
D.转移溶液时,不慎有少量溶液洒到容量瓶外面,移入容量瓶中的溶质硫酸的物质的量减小,所配溶液浓度偏低,故D不符合;
E.最后需要加水定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响,故E不符合;
F.摇匀后液面下降,一部分溶液留在瓶塞与瓶口之间,再加蒸馏水至刻度线,导致溶液体积偏大,所以溶液浓度偏低,故F不符合;
故选:ABC.
本题解析:
本题难度:一般
5、简答题 实验室用固体烧碱配制0.1mol?L-1的NaOH溶液500mL,回答下列问题:
(1)计算需要NaOH固体的质量______g.
(2)有以下仪器和用品:①烧杯?②药匙?③250mL容量瓶?④500mL容量瓶?⑤玻璃棒?⑥托盘天平.配制时,必须使用的仪器或用品有______(填序号),还缺少的仪器是______.
(3)使用容量瓶前必须进行的一步操作是______.
(4)配制时,一般分为以下几个步骤:
①称量?②计算?③溶解?④摇匀?⑤转移?⑥洗涤?⑦定容?⑧冷却?⑨振荡,其正确的操作顺序为______.
(5)配制过程中,下列操作会引起结果偏高的是______(填序号)
①未洗涤烧杯、玻璃棒
②NaOH溶液未冷却至室温就转移到容量瓶
③容量瓶不干燥,含有少量蒸馏水
④称量NaOH的时间太长
⑤定容时俯视刻度.
参考答案:(1)m=CVM=0.1mol?L-1×0.5L×40g/mol=2.0g.
故答案为:2.0g.
(2)配制步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般天平称量固体,把氯化镁倒入烧杯进行溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器有玻璃棒、天平、药匙、烧杯、胶头滴管、500mL容量瓶,所以选取的仪器有①②④⑤⑥;所以还需要胶头滴管.
故答案为:①②④⑤⑥;胶头滴管.
(3)使用容量瓶前必须进行的一步操作是检查容量瓶是否漏水.
故答案为:检查容量瓶是否漏水.
(4)配制步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,所以正确的操作顺序为②①③⑧⑤⑥⑨⑦④.
故答案为:②①③⑧⑤⑥⑨⑦④.
(5)①未洗涤烧杯、玻璃棒,导致溶质的物质的量偏小,配制的溶液浓度偏低;?
②NaOH溶液未冷却至室温就转移到容量瓶,导致溶液的体积偏小,配制溶液的浓度偏高;
③容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液的体积无影响,所以配制的溶液浓度无影响;?
④称量NaOH的时间太长,氢氧化钠易潮解,导致溶质的物质的量偏小,配制溶液的浓度偏低;
⑤定容时俯视刻度,导致溶液的体积偏小,所以配制溶液的浓度偏高;
故选②⑤.
本题解析:
本题难度:一般