微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 升高温度,下列数据不一定增大的是( )
A.化学反应速率v
B.弱电解质的电离平衡常数Ka
C.化学平衡常数K
D.水的离子积常数KW
参考答案:C
本题解析:升高温度,反应速率一定是增大;电离是吸热的,则升高温度,促进电离,电离常数和水的离子积常数都增大;由于可逆反应中正反应不一定是放热反应或吸热反应,所以升高温度平衡常数不一定增大,答案选C。
点评:该题是基础性试题的考查,难度不大,学生只需要记住外界条件对常数的影响即可,有利于培养学生灵活应变能力。
本题难度:一般
2、填空题 欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运?用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
____C?+?____K2Cr2O7?+?____→?____CO2↑+?____K2SO4?+?____Cr2(SO4)3?+?____H2O
请完成并配平上述化学方程式。
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+?2H2(g) CH3OH(g)?△H1=-116?kJ/mol
CH3OH(g)?△H1=-116?kJ/mol
①下列措施中有利于增大该反应的反应速率的是?_______;
A.随时将CH3OH与反应混合物分离?
B.降低反应温度?
C.增大体系压强?
D.使用高效催化剂?
②已知:
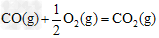 ?△H2=-283?kJ·mol-1?
?△H2=-283?kJ·mol-1?
 ?△H3=-242?kJ·mol-1
?△H3=-242?kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为______________;
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
请回答:

ⅰ)在上述三种温度中,曲线Z对应的温度是___________________;
ⅱ)利用图中a点对应的数据,计算出曲线Z 在对应温度下CO(g)+?2H2(g)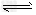 CH3OH(g)?的平衡常数K?=__________。
CH3OH(g)?的平衡常数K?=__________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为7×10-4mol/L?,则生成沉淀所需CaCl2溶液的最小浓度为__________。
参考答案:(1)3?2?8H2SO4?3?2?2?8
(2)①CD;②?CH3OH(g)+3/2O2(g) CO2(g)+?2H2O(g)?△H=-651kJ/mol;③ⅰ)270℃;ⅱ)?4?L2/mol2
CO2(g)+?2H2O(g)?△H=-651kJ/mol;③ⅰ)270℃;ⅱ)?4?L2/mol2
(3)1.6×10-5?mol/L
本题解析:
本题难度:一般
3、选择题 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:
A(g)+xB(g) 2C(g) ΔH=a kJ·mol-1
2C(g) ΔH=a kJ·mol-1
各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如下表和下图:
容器
| 甲
| 乙
| 丙
|
容积
| 0.5 L
| 0.5 L
| 1.0 L
|
温度/℃
| T1
| T2
| T2
|
反应物
起始量
| 1.5 mol A
0.5 mol B
| 1.5 mol A
0.5 mol B
| 6.0 mol A
2.0 mol B
|
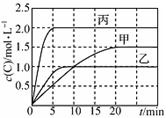
下列说法不正确的是
A.10 min内甲容器中反应的平均速率v(A)=0.10 mol·L-1·min-1
B.其他条件不变,甲容器中在20 min后,降低温度,平衡向正反应方向移动
C.保持其他条件不变,若起始时向乙容器中充入3.0 mol A、1.0 mol B和2.0 mol C,则反应达到新平衡前v(逆)>v(正)
D.T2℃,向丙容器的平衡体系中再充入1.5 mol A、0.5 mol B,平衡时C的体积分数大于25%
参考答案:AD
本题解析:A、由图可知,10min内甲容器中C的浓度变化量为1mol/L,则v(C)=1mol/L÷10min=0.1mol/(L?min),速率之比等于化学计量数之比,所以v(A)=1/2v(C)=1/2×0.1mol/(L?min)=0.05mol/(L?min),故A错误。 B、由图可知,甲乙两容器初始条件相同,但乙先达到平衡,C的转化量降低,说明该反应为放热反应,在其他条件不变时,甲容器中在20 min后,降低温度,平衡向正反应方向移动,正确;C、保持其他条件不变,若起始时向乙容器中充入3.0 mol A、1.0 mol B和2.0 mol C,逆向反应趋势大于正反应趋势, ,正确;D、T2℃,向丙容器的平衡体系中再充入1.5 mol A、0.5 mol B,与之前的反应为等效平衡,平衡时C的体积分数不变,错误;故本题选择AD。
,正确;D、T2℃,向丙容器的平衡体系中再充入1.5 mol A、0.5 mol B,与之前的反应为等效平衡,平衡时C的体积分数不变,错误;故本题选择AD。
考点:化学反应速率和化学平衡
本题难度:困难
4、选择题 某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如图甲所示[t0~t1阶段c(B)未画出]。图乙为t2后改变互不相同的某一条件反应速率随时间变化的关 系图,t3~t4阶段使用了催化剂。下列说法错误的是
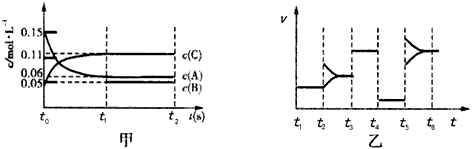
[? ]
A.若t1=15s,生成物C在t0~t1时间段的平均反应速率为0.004 mol·L-1·s-1
B.t4~t5阶段改变的条件为减小压强,t5~t6阶段改变的条件是升高化学反应的温度
C.B的起始物质的量为0.02 mol
D.该化学反应的表达式为:3A(g) B(g)+2C(g)
B(g)+2C(g)
参考答案:C
本题解析:
本题难度:一般
5、简答题 (16分)雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图31-1所示:

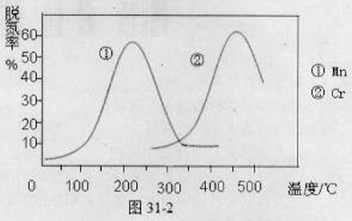
①由图31-1可知SCR技术中的氧化剂为: 。
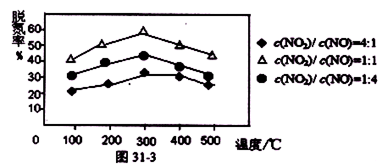
②图31-2是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知最佳的催化剂和相应的温度分别为: 、 。
③用Fe做催化剂时,在氨气足量的情况下,不同c(NO2)/c(NO)对应的脱氮率如图31-3所示,脱氮效果最佳的c(NO2)/c(NO)= 。已知生成1molN2反应放出的热量为QkJ,此时对应的脱氮反应的热化学方程式为 。
(2)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收,具体步骤如下:
SO2(g)+H2O(l) H2SO3(l)
H2SO3(l) H+(aq)+HSO3—(aq) I
H+(aq)+HSO3—(aq) I
HSO3—(aq) H+(aq)+SO32—(aq) II
H+(aq)+SO32—(aq) II
Ca(OH)2(s) Ca2+(aq)+2OH—(aq) III
Ca2+(aq)+2OH—(aq) III
Ca2+(aq)+SO32—(aq) CaSO3(s) IV
CaSO3(s) IV
④步骤II的平衡常数K的表达式为 。
⑤该温度下,吸收液中c(Ca2+)一直保持为0.70mol/L,已知Ksp(CaSO3)=1.4×10-7,则吸收后溶液中的SO32-的浓度。(写出计算过程,保留2位有效数字)
参考答案:(1)① NO、NO2 (2分) ② Mn (2分) 200-250℃或范围内间任意温度(2分)
③1:1 (2分) 2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) ΔH=-2QkJ/mol (3分)
2N2(g)+3H2O(g) ΔH=-2QkJ/mol (3分)
(2) ④K=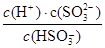 (2分)
(2分)
⑤c(SO32-)=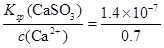 mol/L=2×10-7mol/L(3分)
mol/L=2×10-7mol/L(3分)
本题解析:(1)①根据反应前后元素化合价变化可知,氨气中氮元素的化合价从-3价升高到0价,失去电子被氧化做还原剂;氮氧化合中氮元素的化合价降低,得到电子被还原做氧化剂,因此氧化剂是NO、NO2。
②根据图像可知,两种催化剂的脱氮率几乎是相同的,但Mn所在曲线的温度低,所以由图可知最佳的催化剂和相应的温度分别为Mn和200~250℃或范围内间任意温度。
③根据图像可知c(NO2)/c(NO)=1:1是脱氮率最高,由于每生成1molN2反应放出的热量为QkJ,所以此时对应的脱氮反应的热化学方程式为2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) ΔH=-2QkJ/mol。
2N2(g)+3H2O(g) ΔH=-2QkJ/mol。
(2) ④化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据化学方程式可知,该反应的平衡常数表达式K=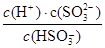 。
。
⑤根据硫酸钙的溶度积常数表达式Ksp(CaSO3)=c(Ca2+)·c(SO32-)可知,c(SO32-)=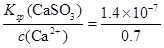 mol/L=2×10-7mol/L。
mol/L=2×10-7mol/L。
考点:考查氧化还原反应、外界条件对平衡状态的影响、平衡常数以及溶度积常数的有关计算
本题难度:困难