微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对于可逆反应A(g) + 2B(g) 2C(g)(正反应吸热),下列图象正确的是
2C(g)(正反应吸热),下列图象正确的是
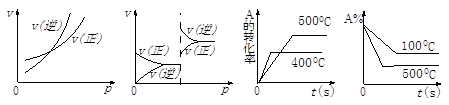
A? B? C? D
参考答案:D
本题解析:A、该反应是一个反应前后体积不变的反应,因此增大压强对正逆反应来讲是同等程度的改变大小,错误;B、错误跟A的原因一样;C、应该遵守“先拐先平,数值大”,错误;D、正确。
本题难度:一般
2、填空题 (13分)难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡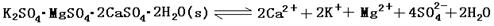
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:

(1)滤渣主要成分有 和 以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因: 。
(3)“除杂”环节中,先加入 溶液,经搅拌等操作后,过滤,再加入 溶液调滤液PH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图14,由图可得,随着温度升高,
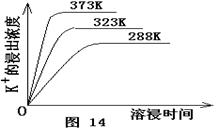
① 在相同时间K+的浸出浓度大。
② 在相同时间K+的浸出浓度减小
③ 反应的速率加快,平衡时溶浸时间短。
④ 反应速率减慢,平衡时溶浸时间增长。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:

已知298K时, Ksp(CaCO3)=2.80×10—9, Ksp(CaSO4)=4.90×10—5 ,求此温度下该反应的平衡常数K 。
参考答案:(1)CaSO4(1分) Mg(OH)2(1分)
(2)氢氧根与镁离子结合,使平衡向右移动,K+变多。(2分)
(3)K2CO3 (2分) H2SO4 (2分)
(4)①③(2分)
(5)K=1.75×104(3分)
本题解析:(1)根据题目给出的可逆溶解平衡,加Ca(OH)2后,Mg 2+变成Mg(OH)2,硫酸钙是微溶物,因此滤渣成分是Mg(OH)2,CaSO4和未溶杂卤石;(2)根据勒夏特列原理,加入Ca(OH)2后,Mg 2+不断沉淀,硫酸钙也析出,平衡正移,因此浸出K+;(3)为了使生成的硫酸钾最纯,要除去加入的过量的氢氧化钙,而进入杂质阳离子,因此加入碳酸钾,最后硫酸钾除去过量的碳酸钾且调节溶液pH值;(4)由已知曲线图观察可知,升高温度可以提高K+浸出率,缩短浸出时间;(5)由题意知:Ksp(CaCO3)=2.80×10-9=c(Ca2+)·c(CO32-),Ksp(CaSO4)=4.90×10-5=c(Ca2+)·c(SO42-),因此有:Ksp =1.75×104。
考点:化学反应平衡原理。
点评:本题在化学工艺流程的背景下对化学反应平衡进行考查,题目难度比较大,综合性较强。
本题难度:困难
3、选择题 在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表
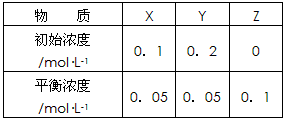
下列说法错误的是
[? ]
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变压强可以改变此反应的平衡常数
参考答案:CD
本题解析:
本题难度:一般
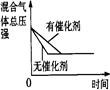
4、选择题 可逆反应N2 (g)+3H2(g) 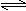 ?2NH3(g) △H<0,下列研究目的和示意图相符的是(? )
?2NH3(g) △H<0,下列研究目的和示意图相符的是(? )
?
| A
| B
| C
| D
|
研究
目的
| 压强对反应的影响
(p2>p1)
| 温度对反应的影响
| 平衡体系增加N2的
浓度对反应的影响
| 催化剂对反应的影响
|
图
| 
| 
| 
| 
|
?
参考答案:C
本题解析:A、对于上述合成氨反应,增大压强平衡向正反应方向移动,则NH3的体积分数增大,与图像一致,但压强增大,化学反应速率加快,到达化学平衡的时间缩短,与图像不符,错误。B、该反应是放热反应,升高温度化学平衡向逆反应方向移动,则N2的转化率降低,图像中N2的转化率随着温度升高而增大,两者不相符,错误。C、反应达到平衡后,增加N2的量,增加N2的瞬间正反应速率增大,逆反应速率不变,然后正反应速率不断减小,逆反应速率不断增大,直到新的平衡,与图像符合,正确。D、催化剂对化学平衡状态无影响,但催化剂能加快化学反应速率,所以有催化剂时达到化学平衡的时间较短,与图像不符,错误。
本题难度:一般
5、填空题 H2O由液态变为气态的过程可以用下式来表示:
H2O(l)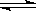 H2O(g)。我们也可以用平衡移动原理来解释这一变化中的一些问题,如:H2O
H2O(g)。我们也可以用平衡移动原理来解释这一变化中的一些问题,如:H2O 的汽化是吸热过程,所以温度升高,平衡向生成更多的H2O(g)的方向移动。请回答下面两个问题:
的汽化是吸热过程,所以温度升高,平衡向生成更多的H2O(g)的方向移动。请回答下面两个问题:
(1)减小压强,平衡向?移动。所以高山上由于空气稀薄,水的沸点比平地上
?(填高或 低)。高压锅中水的沸点比普通锅中水的沸点?(填高或低)。
低)。高压锅中水的沸点比普通锅中水的沸点?(填高或低)。
参考答案:右?低?高
本题解析:略
本题难度:简单